
| Kw |
| C(H+) |
| 10-14 |
| 10-4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(17分)完成下列各题:
(1).在![]() 时,向容积为2L的密闭容器甲中加入1molN2、3 molH2及少量固体催化剂,发生反应N2(g)+3 H2(g)
时,向容积为2L的密闭容器甲中加入1molN2、3 molH2及少量固体催化剂,发生反应N2(g)+3 H2(g)2NH3(g);
![]() ,10min时各物质的浓度不再变化,测得N H3的物质的量为0.4mol。
,10min时各物质的浓度不再变化,测得N H3的物质的量为0.4mol。
①该反应在0—10min时间内H2的平均反应速率为 N2的转化率为
②在![]() 时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molN H3,则达到平衡时NH3的物质的量为( )(填选项字母)
时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1 molN H3,则达到平衡时NH3的物质的量为( )(填选项字母)
a 大于0.4mol b 等于0.4mol c 小于0.4mol
③下图是在![]() 时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在
时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在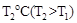 时的H2体积分数随时间t的变化曲线。
时的H2体积分数随时间t的变化曲线。
(2).已知:A酸的溶液pH=a,B碱的溶液pH=b
①若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为( )。
a 大于7 b 等于7 c 小于7
②若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mo1·L–l,B溶液中水电离出的氢离子浓度为 mol·L–1。
③若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH= 。若酸碱按体积比为1:10混合后溶液显中性,
则a+b= 。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol·L-1,B溶液中水电离出的氢离子浓度 为 。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,
混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)
(填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,
其水解反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012届高考化学一轮复习《溶液中的离子反应》专题综合测试(苏教版) 题型:填空题
(8分)已知:A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH=________。酸碱按体积比为1 ∶10混合后溶液显中性,则a+b=________。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为________mol·L-1,B溶液中水电离出的氢离子浓度为________mol·L-1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系为VA________VB(填“>”、“<”或“=”,下同),混合后溶液中的离子浓度关系为c(Na+)________
c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年新疆兵团二中高三第一次月考化学试卷 题型:填空题
(7分)已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH= 。酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mo1·L–l,B溶液中水电离出的氢离子浓度为 mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,混合后溶液中的离子浓度关系为c(Na+) c(CH3COO—)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com