
| A. | 原子半径A>B>C>D | |
| B. | 原子序数d>c>b>a | |
| C. | 离子半径C>D>B>A | |
| D. | 单质的还原性A>B离子的还原性C2?>D? |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,且A、B在周期表中C、D的下一周期,原子序数:a>b>d>c,
A、A、B在周期表中C、D的下一周期,并且原子序数:a>b>d>c,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故A错误;
B、aA2+、bB+、cC2-、dD-都具有相同的电子层结构,所以有:a-2=b-1=c+2=d+1,所以原子序数为a>b>d>c故B错误;
C、aA2+、bB+、cC2-、dD-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,所以离子半径C2->D->B+>A2+,故C正确;
D、同周期自左而右元素金属性减弱,单质还原性减弱,则单质的还原性:B>A,同周期自左而右元素非金属性增强,阴离子的还原性减弱,则还原性为C2?>D?,故D错误;
故选C.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:选择题
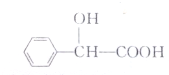 某有机物的结构如下所示,有关该物质的说法错误的是( )
某有机物的结构如下所示,有关该物质的说法错误的是( )| A. | 该物质的分子式为C8H8O3 | |
| B. | 该物质分子中的8个碳原子都在同一个平面上 | |
| C. | 该物质既可以发生酯化反应又可以发生缩聚反应 | |
| D. | 1mol该物质可以与2mol金属Na反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/min | 0 | 20 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.020 | 0.020 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑦ | B. | ②③④⑤⑥ | C. | ③④⑥ | D. | ②③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的浓度相等 | B. | X、Y、Z在容器中共存 | ||
| C. | 正、逆反应速率都等于零 | D. | X、Y、Z的浓度均不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH3 | B. | (CH3)3CCH2CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 | |
| B. | 0.1mol/L氯化铵溶液的pH约为5 | |
| C. | 0.1mol/L氨水可以使酚酞试液变红 | |
| D. | 铵盐受热易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com