
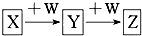 X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图所示转化关系(其他产物已略):下列说法不正确的是( )| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若X是金属铝,则W可能是强碱 | |
| C. | 若W是氢氧化钠,则X与Z可能反应生成Y | |
| D. | 若X为氧气,则X与Y的相对分子质量可能相差12 |
分析 由反应的转化关系可知X可与W连续反应,说明X的生成物与W的量或反应条件有关,符合该转化关系的有:氢氧化钠或氢氧化钾与二氧化碳和二氧化硫的反应、铁和硝酸或氯化铁溶液的反应、偏铝酸盐和盐酸的反应、氯化铝和氢氧化钠溶液的反应、氨气或氮气或硫被氧化的反应、钠被氧化的反应等,以此解答该题.
解答 解:A.如果W是Fe,Z是FeCl2,则Y必是FeCl3,发生的化学反应是2FeCl2+Cl2═2FeCl3,则X是Cl2,符合题干要求,故A正确;
B.若X是金属铝,W是NaOH溶液,则Y为NaAlO2,NaAlO2与NaOH不反应,故B错误;
C.若W是氢氧化钠,说明X能连续与氢氧化钠反应,即Y应是氢氧化物,Y能与氢氧化钠继续反应,说明氢氧化物Y具有酸性,则Y必是氢氧化铝,则X必是含有Al3+的溶液,Al3+水解使溶液呈酸性.Z是AlO2-,Al3+的溶液和AlO2-溶液混合生成氢氧化铝沉淀,故C正确;
D.若X是氧气,W是C,Y是CO2,Z是CO,则X和Y相对分子质量相差12,故D正确.
故选B.
点评 本题考查了无机物的推断,侧重于学生的分析能力的考查,注意把握物质转化关系的应用,物质性质的综合应用,主要考查物质连续反应的特征应用,熟练掌握元素化合物的性质是解题关键,难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,电池内部的电流方向由碳棒流向锌桶 | |
| C. | 甲醇燃料电池工作时,甲醇在负极发生氧化反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油分馏所得的馏分是一种具有固定熔、沸点的纯净物 | |
| B. | 石油裂化的主要目的是提高汽油等轻质油的产量 | |
| C. | 石油裂解的原料是石油分馏产物,包括石油气 | |
| D. | 石油在催化剂的作用下加热,可以使链状烃转化为环状烃(如苯、甲苯等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,H2参与负极反应,发生氧化反应 | |
| B. | 电池放电时,镍元素被氧化 | |
| C. | 电池放电时,电子从氢气这一极到NiO(OH) 这一极 | |
| D. | 电池充电时,电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 蒸馏水 | 氨水 | 氧化铝 | 二氧化硫 |
| B | 盐酸 | 空气 | 硫酸 | 干冰 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 生石灰 | 硫酸 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 许多胶体能进行电泳是因为这些胶体带电 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此把胶体与溶液、悬浊液区分 | |
| C. | 光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应 | |
| D. | 将饱和氯化铁溶液滴入稀氢氧化钠溶液中加热,可得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com