
| ������ | ��2 | ��3 | ||
| ��KMnO���/m | ��20.60 | ��20.02 | ��20.00 | ��9.98 |
���� ��һ��1��NaNO2��Һ��ʾ���ԣ�NaNO2˵��Ϊǿ�������Σ������������ˮ�����Һ��ʾ���ԣ���������������Һ�е������غ������
2��д���÷�Ӧ��ƽ�ⳣ������ʽ��Ȼ�����Ksp��AgNO2����Ksp��AgCl�����м��㣻
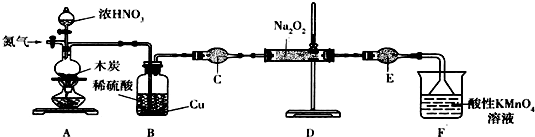
���������Ʊ��������Ƶ�ʵ��װ�ÿ�֪����ͨ�뵪������װ���еĿ����ų���C��Ũ���ᷴӦ���ɶ���������������̼��B�пɳ�ȥ����������CΪ���θ���ܣ�����NO���壬D�з���2NO+Na2O2=2NaNO2��FΪβ���������Դ������
�������ٵ�һ��ʵ���������ĵ����Ը��������Һ���ƫ��
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����±�Һ��ϡ�ͣ���ҺŨ�ȼ�С��
b���ﵽ��������ƿ����Ҫ�����Ӱ�����Һ�����ʵ����ʵ�����
c���ζ��������Ӷ������������ǰ�Һ���·�������������ʵ�����ĵı�Һ���ƫ��
������KMnO4��Һ������������Һ����������ԭ��Ӧ��
�۵�һ���������������������3�����ı�Һ��ƽ��������ٽ�Ϸ�Ӧ����ʽ�������Ʒ���������Ƶ�����������������
��� �⣺��һ��1����������������Һ�д���ˮ��ƽ�⣺NO2-+H2O?HNO2+OH-����������������Һ��ʾ���ԣ���������������Һ�е������غ�ɵã�c��OH-��=c��HNO2��+c��H+������c��HNO2��=c��OH-��-c��H+����
�ʴ�Ϊ��NO2-+H2O?HNO2+OH-��c��OH-��-c��H+����
2����ӦAgNO2��s��+Cl-��aq���TAgCl��s��+NO2-��aq���Ļ�ѧƽ�ⳣ��K=$\frac{c��N{{O}_{2}}^{-}��}{c��C{l}^{-}��}$������Ksp��AgCl��=c��Cl-��•c��Ag+����Ksp��AgNO2��=c��NO2-��•c��Ag+����֪��K=$\frac{c��N{{O}_{2}}^{-}��}{c��C{l}^{-}��}$=$\frac{{K}_{sp}��AgN{O}_{2}��}{{K}_{sp}��AgCl��}$=$\frac{2��1{0}^{-8}}{1.8��1{0}^{-10}}$=$\frac{1000}{9}$��
�ʴ�Ϊ��$\frac{1000}{9}$��
���������Ʊ��������Ƶ�ʵ��װ�ÿ�֪����ͨ�뵪������װ���еĿ����ų���C��Ũ���ᷴӦ���ɶ���������������̼��B�пɳ�ȥ����������CΪ���θ���ܣ�����NO���壬D�з���2NO+Na2O2=2NaNO2��FΪβ��������
��1��������������֪������װ��Aǰ����ͨһ��ʱ��N2��Ŀ�����ų�װ���еĿ�����
�ʴ�Ϊ���ų�װ���еĿ�����
��2��װ��A��ľ̿��Ũ�����ڼ��������·�����Ӧ�Ļ�ѧ����ʽΪC+4HNO3$\frac{\underline{\;����\;}}{\;}$CO2+4NO2+2H2O��װ��B����NO2�ܽ���ˮ���ɵ�ϡ������ͭ��Ӧ���ȳ�ȥ��NO2��ͬʱ����NO��Ϊ�����ṩԭ�ϣ�
�ʴ�Ϊ��C+4HNO3$\frac{\underline{\;����\;}}{\;}$CO2+4NO2+2H2O����NO2 ����ת��ΪNO��Ϊ���淴Ӧ�ṩԭ�ϣ�
��3��װ��������CΪ����ܣ�ʢ�Ź�������Ϊ��ʯ�ң�
�ʴ�Ϊ������ܣ���ʯ�ң�
�������ٵ�һ��ʵ���������ĵ����Ը��������Һ���ƫ�ᵼ�²������ƫ�ߣ�
a����ʽ�ζ���������ˮϴ����δ�ñ�Һ��ϴ�����±�Һ��ϡ�ͣ��ζ����������ĵı�Һ�����ƫ��a��ȷ��
b����ƿ����Ҫ���������ƿϴ����δ�����Ӱ��ⶨ�������b����
c���ζ��������Ӷ��������¶���ƫ������ı�Һ���ƫ��c��ȷ��
�ʴ�Ϊ��ac��
������KMnO4��Һ������������Һ����������ԭ��Ӧ�����ӷ���ʽ��6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
�ʴ�Ϊ��6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O��
�����ڵ�һ������ƫ�ߣ�Ӧ�������������������ı�Һƽ�����Ϊ��$\frac{20.20+20.00+19.98}{3}$mL=20.00mL��
25mL��Ʒ���ĸ�����ص����ʵ���Ϊ0.1000mol/L��0.02L=0.002mol����250mL��Ʒ��Һ�����ĸ�����ص����ʵ���Ϊ0.002mol��$\frac{250ml}{25ml}$=0.02mol�����ݻ��ϼ۱仯�ɵ÷�Ӧ��ϵʽ��2MnO4-��5NO2-����4.000g��Ʒ�к����������Ƶ����ʵ���Ϊ0.02mol��$\frac{5}{2}$=0.05mol������Ϊ69g/mol��0.05mol=3.45g�����Է�Ӧ��Ĺ������������Ƶ���������Ϊ��$\frac{3.45g}{4.000g}$��100%=86.25%��
�ʴ�Ϊ��86.25%��
���� ���⿼�����ʵ��Ʊ�ʵ�鼰���ʼ���Ϊ��Ƶ���㣬�����Ʊ�ʵ��ԭ����ʵ��װ�����á�ʵ�鼼�ܵ�Ϊ���Ĺؼ������ط�����ʵ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ����Ӧԭ����ʵ�����ϵ�ѵ������Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£���22.4LHCl����1Lˮ�������1mol•L-l��ϡ���� | |
| B�� | ��100mL18mol•L-1��ŨH2SO4��100mLˮ��ϣ������9moI•L-l��H2SO4��Һ | |
| C�� | ��4.0gNaOH����100mL����ƿ�У���ˮ���̶��ߣ����1mol•L-1��NaOH��Һ | |
| D�� | ��0.1molNaCl���100mL��Һ������ȡ��10mL����ȡ����Һ�����ʵ���Ũ��Ϊ1mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | O3 | B�� | CO | C�� | Cl2 | D�� | NH3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
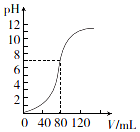 ��1.0mol•L-l NaOH��Һ�к�ijŨ��H2SO4��Һʱ����pH������NaOH��Һ�������V����ϵ��ͼ��ʾ����ԭ������Һ�����ʵ���Ũ�Ⱥ�ǡ���к�ʱ��Һ��������ֱ��ǣ������Ϻ���Һ�����Ϊ�������֮�ͣ���������
��1.0mol•L-l NaOH��Һ�к�ijŨ��H2SO4��Һʱ����pH������NaOH��Һ�������V����ϵ��ͼ��ʾ����ԭ������Һ�����ʵ���Ũ�Ⱥ�ǡ���к�ʱ��Һ��������ֱ��ǣ������Ϻ���Һ�����Ϊ�������֮�ͣ���������| A�� | 0.5 mol•L-1��160 mL | B�� | 1.0 mol•L-1��160 mL | ||
| C�� | 0.5 mol•L-1��80 ml | D�� | 1.0 mol•L-1��80 ml |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
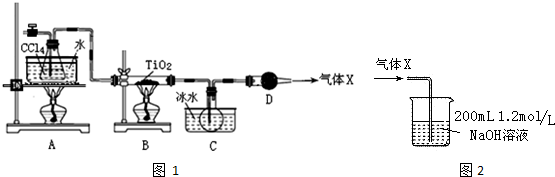
| ���� | �۵�/�� | �е�/�� | ���� |
| CCl4 | -23 | 76.8 | ��TiCl4���� |
| TiCl4 | -25 | 136 | ����ʪ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
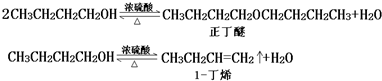
| ������ | �ܶȣ�g•cm-3�� | ˮ���� | �е㣨�棩 |
| ������ | 1.05 | ���� | 118.1 |
| ������ | 0.80 | �� | 117.2 |
| ������ | 0.77 | ���� | 142.0 |
| ���������� | 0.90 | �� | 126.5 |
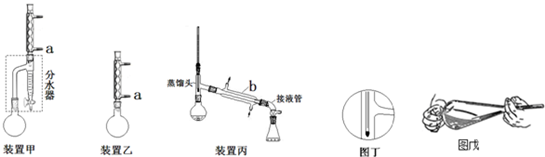

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
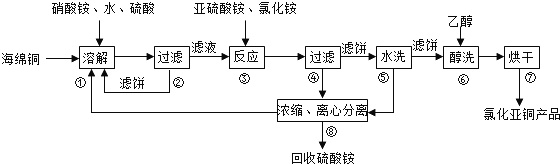
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CxHy��l��+��x+$\frac{y}{4}$��O2��g��=xCO2��g��+$\frac{y}{2}$H2O��l����H=��$\frac{10Q}{9}$-1366.8��kJ•mol-1 | |
| B�� | CxHy��l��+��x+$\frac{y}{4}$��O2��g��=xCO2��g��+$\frac{y}{2}$H2O��l����H=��-$\frac{10Q}{9}$+1366.8��kJ•mol-1 | |
| C�� | CxHy��l��+��x+$\frac{y}{4}$��O2��g��=xCO2��g��+$\frac{y}{2}$H2O��l����H=��$\frac{10Q}{9}$-151.9��kJ•mol-1 | |
| D�� | CxHy��l��+��x+$\frac{y}{4}$��O2��g��=xCO2��g��+$\frac{y}{2}$H2O��l����H=��-$\frac{10Q}{9}$+151.9��kJ•mol-1 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com