
如图所示为实验室制SO2并验证SO2的某些性质的装置图。
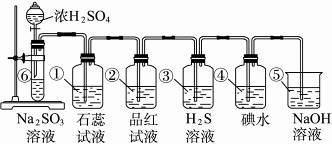
试完成下列问题:
(1)⑥中反应的化学方程式为_____________。
(2)①中的实验现象为_____________,此实验证明SO2是_____________气体。
(3)②中的品红溶液_____________,证明SO2有_____________性。
(4)③中的实验现象是_____________,证明SO2有_____________性。
(5)④中的实验现象是_____________,证明SO2有_____________性。
(6)⑤的作用是_____________,反应的化学方程式是__________________________。
科目:高中化学 来源: 题型:阅读理解

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.4 | 5.2 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| ||
| ||


| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| △ |
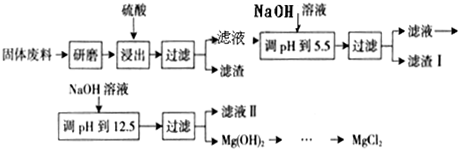
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
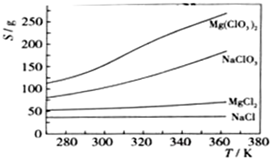
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(Ⅰ)德国人哈伯在1905年发明的合成氨反应原理为:N2(g)+3H2(g) ![]() 2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
2NH3(g);已知298 K时,ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1.试回答下列问题:
(1)请根据正反应的焓变和熵变计算分析298 K下合成氨反应能自发进行(列出算式即可)___________________.其浓度熵(Qc) __________________化学平衡常数(Kc)(填“大于”“等于”或“小于”)时,反应向右进行.
(2)在实际工业合成氨生产中采取的措施是__________________ (填序号).
A.采用较低压强
B.采用800 K左右的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,N2和H2循环到合成塔中并补充N2和H2
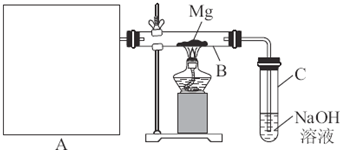
(3)如下图所示是实验室模拟工业法合成氨的简易装置,简述检验有氨气生成的方法
___________________________________________________________________________
___________________________________________________________________________.

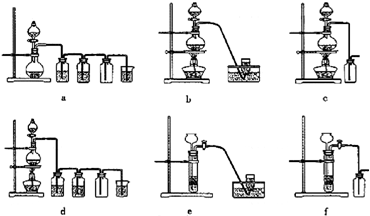
(Ⅱ)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取.某校化学兴趣小组的同学设计了如下图所示装置利用中学实验室常见试剂制取NH3,并以空气,NH3为原料模拟工业制HNO3(三氧化二铬为催化剂,加热及夹持装置未画出):

回答下列问题:
(1)实验时,A,C两装置均需加热,应先加热______________装置,原因是___________________;
(2)D装置中应填充的物质是______________,该物质的主要作用是______________;
(3)E装置的作用是______________,F,G装置中的物质分别是______________、______________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在如下图所示的方框中画出装置图并注明所用药品的名称).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com