
 如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.
如图为某市所售盐酸试剂瓶标签上的部分数据.通过计算回答.分析 (1)依据C=$\frac{1000ρω}{M}$计算氯化氢的物质的量浓度;
(2)依据n=$\frac{m}{M}$金属锌的质量,依据Zn+2HCl=ZnCl2+H2↑计算产生氢气的体积.
解答 解:(1)依据图中所售盐酸试剂瓶标签上数据可知:氯化氢的摩尔质量为:36.5g/mol,密度为1.18g/ml,氯化氢的质量分数为36.5%,则氯化氢的物质的量浓度C=$\frac{1000ρω}{M}$=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L;
答:该盐酸中HCl的物质的量浓度11.8mol/L;
(2)6.50g锌物质的量n=$\frac{6.5g}{65g/mol}$=0.1mol,盐酸足量,应依据锌的量计算氢气的物质的量,设生成标况下氢气体积为V,则:
Zn+2HCl=ZnCl2+H2↑
1 22.4L
0.1mol V
解得V=2.24L;
答:将6.50g锌投入足量的该盐酸中,充分反应后生成的H2在标准状况下的体积2.24L.
点评 本题考查物质的量浓度的计算,明确物质的量浓度与质量百分数浓度之间的换算公式,明确锌与盐酸反应的方程式即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L气体氘气(D2)中含有0.5NA个中子 | |
| B. | 1 L 0.1 mol•L-1醋酸溶液中含有0.1NA个氢离子 | |
| C. | 电解精炼铜时,若电路中转移0.2NA个电子,则阳极质量一定减少6.4 g | |
| D. | NO2和H2O反应每生成2 mol HNO3时被还原的NO2分子数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气则遇氨就会产生白烟 | |
| B. | 该反应利用了Cl2的强氧化性 | |
| C. | 实验室可用 NH4Cl受热分解制取NH3 | |
| D. | 生成1 molN2有6 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧化物为Fe2O3 | |
| B. | 该氧化物具有较高的熔点 | |
| C. | 该氧化物易溶于水 | |
| D. | 该氧化物能与强酸反应,但不能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaSO4和CaSO3 | B. | CaSO4 | C. | CaS | D. | CaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳分子的比例模型 | B. | NH3的电子式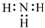 | ||
| C. | 乙烷的分子式 CH3CH3 | D. | 丙烯的结构简式 CH3CH=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b>c>d | B. | a>c>d>b | C. | c>a>b>d | D. | b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com