
| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
分析 Na2CO3属于强碱弱酸盐,在溶液中碳酸根离子会发生水解,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,结合电荷守恒、质子守恒分析.
解答 解:A.水电离出的氢离子等于氢氧根离子,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,所以c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),故A错误;
B.碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,Na2CO3溶液存在水解平衡CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3-+OH-,根据钠和碳间的关系可得$\frac{1}{2}$c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),故B错误;
C.碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,c(Na+)>c(CO32-),Na2CO3属于强碱弱酸盐在溶液中碳酸根离子会发生水解,碳酸根离子是多元弱酸阴离子分步水解,水解的离子方程式为:CO32-+H2O?OH-+HCO3-,HCO3-+H2O?H2CO3-+OH-,所以c(CO32-)>c(OH-)>c(HCO3-),故C正确;
D.根据电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+(OH-),故D错误;
故选C.
点评 本题考查了盐的水解原理,注意把握盐的水解对盐电离出来的离子浓度的影响,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
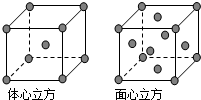 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子. ,分子中有2个σ键,2个π键.
,分子中有2个σ键,2个π键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | K2CO3 | C. | ZnSO4 | D. | Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
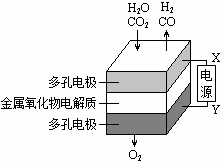 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ CO2+2eˉ=═CO+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 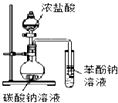 如图证明酸性:盐酸>碳酸>苯酚 | |
| B. | 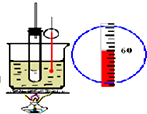 如图实验室制硝基苯 | |
| C. | 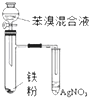 如图验证苯和液溴在催化剂作用下发生取代反应 | |
| D. | 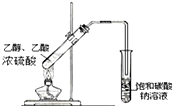 如图实验室制乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com