
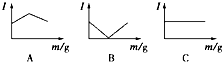
 在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.
在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,如下图所示是其电流(Ⅰ)随新物质加入量(m)的变化曲线.| A | B | C | |
| A | ① | ② | ③ |
| B | ④ | ②③ | ① |
| C | ③ | ①② | ④ |
| D | ② | ①③ | ④ |
| A. | A | B. | B | C. | C | D. | D |
分析 溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,据此分析解答.
解答 解:溶液导电能力与离子浓度成正比,与电荷成正比,与电解质强弱无关,
A中溶液导电能力先增大后减小,则A溶液中离子浓度先增大后减小;
B中溶液导电能力先减小后增大,则B溶液中离子浓度先减小后增大;
C中溶液导电能力不变,说明C溶液中离子浓度不变,
①该反应方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,随着稀硫酸的加入,离子浓度减小,当二者恰好反应时离子浓度最小,溶液导电能力最小;继续加入稀硫酸时,离子浓度增大,溶液导电能力增大;
②离子反应方程式为CH3COOH+NH3.H2O=NH4++CH3COO-,随着一水合氨的加入,离子浓度增大,溶液导电能力增大,二者恰好反应时溶液导电能力最大;继续加入氨水,离子浓度减小,溶液导电能力减小;
③离子反应方程式为Ca2++2OH-+CO2=CaCO3↓+H2O,随着二氧化碳的通入,离子浓度减小,溶液导电能力降低,二者恰好反应时离子浓度最小,溶液导电能力最低,继续通入二氧化碳,二者反应生成可溶性强电解质,CaCO3+H2O+CO2=Ca(HCO3)2,离子浓度增大,溶液导电能力增强;
④离子反应方程式为NH4++OH-=NH3.H2O,随着NaOH的加入,离子浓度基本不变,所以溶液导电能力基本不变;
通过以上分析知,与A图变化趋势一致的是②,与B图变化趋势一致的是①③,与C图变化趋势一致的是④,
故选D.
点评 本题考查溶液导电能力图象分析,为高频考点,明确溶液导电性强弱与离子浓度关系是解本题关键,注意溶液导电性强弱与电解质强弱无关,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 | |
| B. | pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L | |
| C. | 饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) | |
| D. | 0.1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成42.0 L N2(标准状况) | |
| B. | 有0.250 mol KNO3被氧化 | |
| C. | 转移电子的物质的量为2.5 mol | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: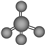 | |
| B. | 氯离子的结构示意图: | |
| C. | CH3CH2CH3和CH3CH2CH2CH3互为同分异构体 | |
| D. | KCl的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com