
【题目】今有甲、乙、丙三瓶等体积的新制的氯水,浓度均为0.1molL-1。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量NaHSO3(mmol),丙瓶不变,片刻后甲、乙、丙三瓶溶液中HClO的物质的量的浓度大小关系是(溶液体积变化忽略不计)( )
A.甲=乙>丙B.甲>乙>丙C.丙>甲=乙D.甲>丙>乙
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在t ℃时,AgI在水中的沉淀溶解平衡曲线如图所示,又知t℃时AgBr的Ksp=5×10-13。下列说法不正确的是( )

A.在t℃时,AgI的Ksp=2.5×10-15 mol2.L-2
B.图中b点有碘化银晶体析出
C.向c点溶液中加入适量蒸馏水,可使溶液由c点到a点
D.在t℃时,反应AgBr(s)+I-(aq)![]() AgI(s)+Br-(aq)的平衡常数K=200
AgI(s)+Br-(aq)的平衡常数K=200
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:C![]() CO+H2
CO+H2![]() CO2+H2O 途径b:C
CO2+H2O 途径b:C![]() CO2
CO2
C.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜
D.生石灰、铁粉、硅胶是食品包装中常用的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验一:碘含量的测定
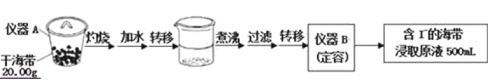
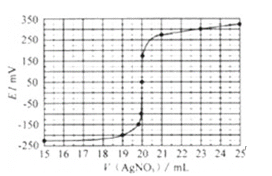
取0.0100mol/L的AgNO3标准溶液滴定100.00mL海带浸取原液,用电势滴定法测定碘的含量.测得的电动势(E)反映溶液中c(I﹣) 变化,用数字传感器绘制出滴定过程中曲线变化如图所示:
实验二:碘的制取
另取海带浸取原液,甲、乙两种实验方案如图所示:
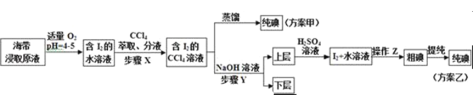
已知:3I2+6NaOH→5NaI+NaIO3+3H2O
请回答:
(1)实验一中的仪器名称:仪器A______,仪器B______;实验二中操作Z的名称______.
(2)根据表中曲线可知:此次滴定终点时用去AgNO3溶液的体积为______ml,计算该海带中碘的百分含量为______.
(3)步骤X中,萃取后分液漏斗内观察到的现象是______.
(4)下列有关步骤Y的说法,正确的是______
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
方案乙中,上层液体加硫酸发生反应的离子方程式是______.
(5)方案甲中采用蒸馏不合理,理由是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏伽德罗常数可用NA表示,下列叙述中正确的是( )
A.1mol H2O所含的原子数为NA个
B.16g O2-含有的电子数为10NA个
C.常温常压下,11.2L Cl2所含分子数为0.5NA个
D.1L 1mol/L NaClO溶液中含ClO-个数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物在生产生活中有广泛应用,其吸收处理也十分重要。
(1)完成并配平下列离子方程式_____。
Fe3++ SO2+ → Fe2++ SO42-+
(2)标明电子转移的方向和数目______: Fe3++ SO2……。
(3)在Na2SO3溶液中滴加酚酞,溶液呈红色,若在该溶液中滴入过量的BaCl2溶液,实验现象为:_____。请结合离子方程式,运用平衡原理进行解释_____。
(4)在NaClO溶液中通入SO2,写出反应的离子方程式:_____。
(5)在0.1mol/LNa2SO3溶液中,下列关系式正确的是_____。
a.[Na+]+[H+]=[SO32-]+[HSO3-]+[OH-] b.[Na+]>[SO32-]>[OH-]>[H+]
c.[Na+]=2[SO32-]+2[HSO3-]+2[H2SO3] d.[Na+]=2[SO32-]>[OH-]=[H+]
(6)向该溶液中加入少量Na2SO3固体,![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年,中国首次应用六炔基苯在铜片表面合成了石墨炔薄膜(其合成示意图如右图所示),其特殊的电子结构将有望广泛应用于电子材料领域。下列说法不正确的是( )
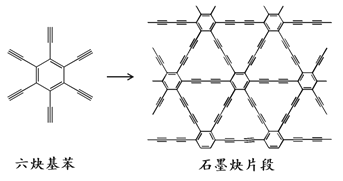
A.六炔基苯的化学式为C18H6
B.六炔基苯和石墨炔都具有平面型结构
C.六炔基苯和石墨炔都可发生加成反应
D.六炔基苯合成石墨炔属于加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性氧化锌是一种多功能性的新型无机材料.某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
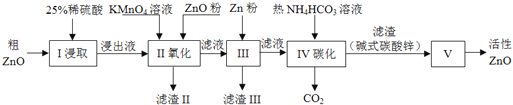
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯外,还需要_______(选填编号)
A.电子天平 B.量筒 C.容量瓶 D.胶头滴管
(2)步骤II中通过加入KMnO4氧化,并用ZnO调节pH,可以除去含铁杂质.检验沉淀是否完全的实验操作是_________.调节pH的适宜范围是_________.
(3)步骤III中加入Zn粉的作用是:①________;②进一步调节溶液pH.
(4)步骤IV中使用热NH4HCO3溶液能促进Zn2+转化为沉淀,但温度不宜过高,其原因可能是________.
(5)步骤V在_______(填仪器名称)中进行,已知碱式碳酸锌的化学式为Zn5(OH)6(CO3)2,请写出发生反应的化学方程式:________.判断已分解完全的操作是________.
(6)用如下方法测定所得活性氧化锌的纯度:
①取1.000g活性氧化锌,用15.00mL 1.000mol/L硫酸溶液完全溶解
②用浓度为0.500mol/L的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL.
假设杂质不参与反应,则所得活性氧化锌的纯度为_______.若在滴定时,实际操作中过量半滴(1mL溶液为25滴),则本次滴定的相对误差为_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
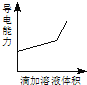
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com