
将34.2g C12H22O11(蔗糖)溶解在100 mL水中。关于所组成的溶液,下列叙述中正确的是
A.该溶液中溶质的物质的量浓度为1 mol·L-1
B.该溶液溶质的质量分数为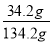 ×100%
×100%
C.该溶液中溶质的物质的量浓度的确定无需知道溶液的密度
D.该溶液溶质的质量分数的确定还需知道溶液的密度
科目:高中化学 来源:2016届河南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.NH3的喷泉实验说明氨气极易溶入水
B.NO和NH3均可用排空气法收集
C.盛液溴的瓶加少量水或防止液溴的挥发
D.NH3遇到挥发性强酸就能冒白烟
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第三次月考化学试卷(解析版) 题型:实验题
某课外活动小组欲对铝镁合金进行研究,测定其中镁的质量分数,他们利用盐酸、氢氧化钠溶液设计了三种不同的实验方案:
方案一:铝镁合金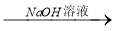 测定生成气体的体积
测定生成气体的体积
方案二:铝镁合金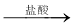 测定生成气体的体积
测定生成气体的体积
方案三:铝镁合金 溶液
溶液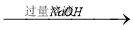
 称量灼烧产物的质量。
称量灼烧产物的质量。
(1)写出方案一中发生反应的离子方程式 。
(2)实验小组根据方案=设计了两个实验装置,如下圈(图中的铁架台已省略)。
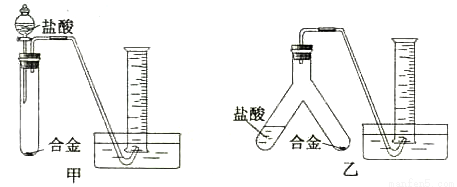
你认为选择 (选填甲或乙)装置进行实验更合理,误差更小。
(3)用方案三进行实验时,除了称量灼烧产物质量外,还需称量的是 。
(4)拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量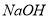 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入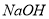 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示:
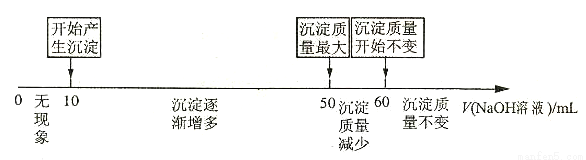
请你判断,根据上图数轴申的数据能否求出合金中镁的质量分数? _______(选填“能”或“不能”)
下列①②两题选一题作答。
①若不能求出合金中镁的质量分数,请说明理由 。
②若能求出合金中镁的质量分数,则镁的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
某合金只含Al、Fe、Cu,为分析其组成,称取ag样品,设计下列实验流程:
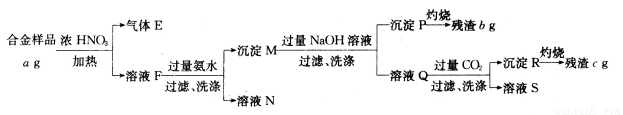
下列相关叙述不正确的是
A.气体E呈红棕色,不能直接排放
B.溶液S中所含溶质、沉淀R都可用作药物
C.合金样品中Cu的质量分数为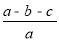 ×100%
×100%
D.合金样品中Al的质量分数为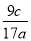 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:填空题
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
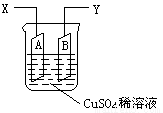
(1)当以IA的电流电解6min后,测得铜片A质量减少2.56g,则图装置中的X端应与直流电的 极相连。
(2)电解后将电源反接,2IA的电流电解6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度 mol/L。溶液中H+的物质的量浓度为 mol/L。
(3)列式计算实验测得的阿伏加德罗常数NA(用I表示) mol-1。(已知电子电量e=1.60×10–19C)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期11月月考化学试卷(解析版) 题型:选择题
如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为: NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g),相关说法正确的是
2N2(g)+3H2O(g),相关说法正确的是
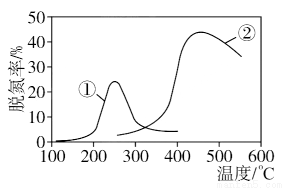
A.上述反应的正反应为吸热反应
B.催化剂①、②分别适合于250 ℃和450 ℃左右脱氮
C.曲线①、②最高点表示此时平衡转化率最高
D.相同条件下,改变压强对脱氮率没有影响
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:选择题
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是

A.电极a为电池的正极
B.电极b上发生的电极反应为:O2+2H2O+4e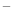 = 4 OH
= 4 OH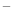
C.电路中每流过4mol电子,电池内部释放632kJ热能
D.每17gH2S参与反应,有1mol H+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江哈尔滨六中高一10月月考化学试卷(解析版) 题型:选择题
4g NaOH溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液物质的量浓度是
A. 1mol/L B. 10mol/L C. 0.01mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:实验题
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaO H溶液,有红褐色沉淀生成,则溶液中一定存在________ .
H溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 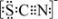 .甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是 .
②甲同学通过实验证明了SCN― 中氮元素转化为NO3― ,已知SCN― 中碳元素没有被氧化,若SCN― 与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1) 写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN― 被双氧水氧化为HCO3― ,同时放出NH3,该反应的离子方程式:________ 。
(2)Cu2+可作为双氧水氧化CN― 中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN― 是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN― 浓度可用离子色谱仪测定)
步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ _______________________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com