
| A. | NO | B. | N2O | C. | NO2 | D. | NH4NO3 |
分析 n(Mg)=$\frac{4.80g}{24g/mol}$=0.2mol,n(HNO3)=0.1L×5mol/L=0.5mol,反应生成0.2molMg(NO3)2,0.4molHNO3表现酸性,此时存在两种可能性,①0.1molHNO3都表现氧化性,结合电子守恒计算即可,
②0.1molHNO3是既表现氧化性也表现酸性.
解答 解:n(Mg)=$\frac{4.80g}{24g/mol}$=0.2mol,n(HNO3)=0.1L×5mol/L=0.5mol,反应生成0.2molMg(NO3)2,0.4molHNO3表现酸性,此时存在两种可能性,
①0.1molHNO3都表现氧化性,设HNO3的还原产物中N的化合价是x,
根据得失电子守恒,0.2mol×2=0.1mol×(5-x),解得x=1,所以HNO3的还原产物中N元素是+1价,因此N2O正确;
②0.1molHNO3是既表现氧化性也表现酸性,因此NH4NO3符合,
故选BD.
点评 本题考查学生氧化还原反应中电子守恒的计算知识,注意知识的归纳和迁移应用是关键,难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只需加KSCN溶液 | B. | 只需加NaOH溶液 | ||
| C. | 先加KSCN溶液,再加氯水 | D. | 先加氯水,再加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NH4Cl溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L的CH3COOH溶液:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) | |
| C. | pH=4的FeCl3溶液:c(Cl-)>c(H+)>c(Fe3+)>c(OH-) | |
| D. | pH=11的CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素符号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5,+3,-3 | -2 |
| A. | 一定条件下,Z的单质与W的常见单质直接生成ZW2 | |
| B. | Z最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| C. | Y的最高价氧化物对应水化物溶于氨水 | |
| D. | 相同条件下,X,Y的单质分别与盐酸反应时,后者反应剧烈些 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
取5等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的
N2O4(g),△H<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的 关系图。下列示意图中,可能与实验结果相符的是( )
关系图。下列示意图中,可能与实验结果相符的是( )

查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:实验题
(1)欲验证某溶液中含有较大量的Cl-、CO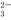 、S
、S O
O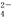 三种离子,如果只取一次该溶
三种离子,如果只取一次该溶 液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
液,分别用三种试剂将三种离子检验出来(要求每一种试剂能检验出一种离子)。假设所加试剂均为足量,则加入试剂的先后顺序为(写化学式)____________、______________、____________。
(2)溶液中存在Mg2+、Ag+、Ba2+三种金属离子,现用NaOH、Na2CO3、NaCl三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序写出对应的离子方程式_______________、_______________、________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列有关物质用途的说法中,不正确的是
A.液氨常用作制冷剂 B.硅可用来制造半导体材料
C.CuO常用于制造红色油漆 D.铝合金可用于制造门窗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com