
| A、第一电离能:Y小于X |
| B、若X、Y均为非金属,则气态氢化物的稳定性:HmY小于HnX |
| C、若X、Y均为非金属,则含氧酸的酸性:X对应的酸性强于Y对应的 |
| D、若X、Y均为金属,则最高价氧化物对应水化物的碱性:X对应的碱性强于Y对应的 |


科目:高中化学 来源: 题型:
A、标准状况下,密度为d g/L的某气体纯净物一个分子的质量为
| ||
| B、25℃时,1g水中含H+离子个数约为10-10NA | ||
| C、常温常压下,20g羟基(-18OD)所含的电子数为9NA | ||
| D、1L pH=1的硫酸溶液中,含有0.2NA个H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g | B、20g |
| C、22g | D、24g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O | 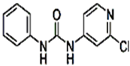 | 白色结晶粉末 | 170~172°C | 易溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应生成了1.5mol的水蒸气 |
| B、用O2表示该反应速率为2.5mol/(L?min) |
| C、反应后容器中NO的浓度为0.5mol/L |
| D、反应后容器中n(NH3)=n(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com