



科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
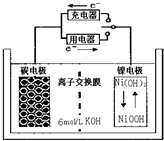 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池用6mol/L 的KOH溶液作电解质溶液,下列说法中正确的是( )| A、充电时OH-向碳电极移动 |
| B、充电时将镍电极与电的负极相连 |
| C、放电时碳电极反应为:H2-2e-=2H+ |
| D、放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molNaOD溶于重水制成1L溶液,pD=13 |
| B、将pD=4的DCl的重水溶液稀释100倍,所得溶液pD=6 |
| C、向30mL0.5mol?L-1NaOD的重水溶液中加入20mL0.5mol?L-1DCl的重水溶液,所得溶液pD=13 |
| D、pD=10的NaOD的重水溶液中,由重水电离出的c(OD-)为1×10-10mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸银溶液中加入铜粉:Ag++Cu=Cu2++Ag |
| B、过氧化钠投入水中发生反应:2O22-+2H2O=4OH-+O2↑ |
| C、向澄清石灰水中通入足量二氧化碳:OH-+CO2=HCO3- |
| D、金属铝溶于氢氧化钠溶液中:Al+2OH-=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、①③ |
| C、①②③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、氯化镁溶液中滴入氢氧化钠溶液:MgCl2+2OH-═Mg(OH)2↓+2Cl- |
| D、氯化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com