
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
分析 向铝灰中加入过量稀H2SO4,A12O3和少量FeO•xFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子;加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体.
(1)氧化铝是两性氧化物溶于强酸强碱;
(2)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物;
(3)依据金属阳离子沉淀开始和完全沉淀需要的溶液PH分析,亚铁离子被氧化为铁离子,调节溶液PH使铁离子全部沉淀;
(4)①浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
②加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子.
解答 解:(1)硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O;
故答案为:Al2O3+6H+=2Al3++3H2O;
(2)反应中MnO4-→Mn2+,Fe2+→Fe3+,MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为$\frac{7-2}{3-2}$=5,由元素守恒可知,Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:1;5;H+;1;5;4H2O;
(3)向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,铁离子开始沉淀和沉淀完全的溶液PH为1.5--2.8,铝离子和亚铁离子开始沉淀的溶液PH大于3,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(4)一定条件下,MnO4-可与Mn2+反应生成MnO2
①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体;
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;
故答案为:除去过量的MnO4-.
点评 本题考查了镁、铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
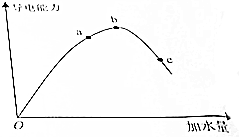 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Br2的CCl4溶液鉴别CH2=CH2和HC≡CH | |
| B. | 用AgNO3溶液鉴别KCl溶液和MgCl2溶液 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
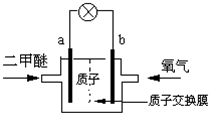 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com