
【题目】氯碱工业中电解饱和食盐水的原理示意图如图:
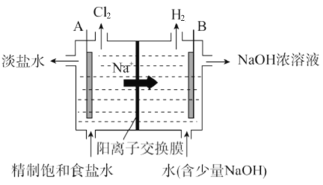
(1)电极 A 是_________(填“阴极”或“阳极”),判断依据为_________。
(2)写出电极 B 的电极反应式_________。
(3)写出电解饱和食盐水的化学方程式_________。
(4)一段时间后,电极 B 周围 NaOH 稀溶液转变为浓溶液,原因:_________。
(5)电解时,工业用盐酸调节 A 室的 pH=2~3,请用化学平衡原理解释原因_________。
【答案】阳极 阳极发生氧化反应 ![]()
![]() 电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大 溶液中存在化学平衡
电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大 溶液中存在化学平衡![]() ,调节pH为2~3,使平衡逆向移动,减少氯气的损失
,调节pH为2~3,使平衡逆向移动,减少氯气的损失
【解析】
(1)电极A 发生![]() ,化合价升高,发生氧化反应,故是阳极,判断依据为阳极发生氧化反应,故答案为:阳极 阳极发生氧化反应;
,化合价升高,发生氧化反应,故是阳极,判断依据为阳极发生氧化反应,故答案为:阳极 阳极发生氧化反应;
(2)电极B为阴极,电极反应式![]() ,故答案为:
,故答案为:![]()
(3)从装置图中根据物质的进出分析可知电解饱和食盐水的化学方程式![]() ,故答案为:
,故答案为:![]()
(4)一段时间后,电极B为阴极,产生大量的OH-,左侧的Na+则可以透过阳离子交换膜进入右侧,故电极B周围 NaOH 稀溶液转变为浓溶液,故答案为:电极B是阴极,产生OH-,Na+从左侧进入右侧,故NaOH浓度增大;
(5)因为氯气能溶于水,溶于水的部分氯气与水反应存在化学平衡![]() ,电解时,工业用盐酸调节 A 室的 pH=2~3,是通过增大H+和Cl-浓度来使平衡逆向移动,减小氯气的损失,故答案为:溶液中存在化学平衡
,电解时,工业用盐酸调节 A 室的 pH=2~3,是通过增大H+和Cl-浓度来使平衡逆向移动,减小氯气的损失,故答案为:溶液中存在化学平衡![]() ,调节pH为2~3,使平衡逆向移动,减少氯气的损失。
,调节pH为2~3,使平衡逆向移动,减少氯气的损失。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】次磷酸![]() 是一种具有强还原性的一元弱酸,工业上常利用
是一种具有强还原性的一元弱酸,工业上常利用![]() 和
和![]() 溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中正确的是
溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中正确的是![]()
A.![]() 中磷元素的化合价为
中磷元素的化合价为![]()
B.![]() 的电离方程式为
的电离方程式为![]()
C.![]() 被
被![]() 氧化成了
氧化成了![]()
D.![]() 、
、![]() 、
、![]() 均为酸式盐
均为酸式盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与
与![]() 催化重整反应为
催化重整反应为![]()
![]() 。现向
。现向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,不同温度下平衡体系中
进行催化重整反应,不同温度下平衡体系中![]() 和CO的体积分数
和CO的体积分数![]() 随温度变化如下表所示:
随温度变化如下表所示:
体积分数 温度 |
|
|
| a | a |
| c | b |
测得:![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
A.![]() 大于
大于![]()
B.![]() 时该反应的平衡常数为
时该反应的平衡常数为![]()
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,达到平衡时,
进行催化重整反应,达到平衡时,![]() 为
为![]()
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,此时反应可能正向移动
进行催化重整反应,此时反应可能正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有 0.1 mol/L 的四种溶液:①HCl ②CH3COOH ③NaOH ④Na2CO3
(1)用化学用语解释溶液①呈酸性的原因:_________。
(2)溶液③的 pH=_________。
(3)溶液①、②分别与等量的溶液③恰好完全反应,消耗的体积:①_________②(填“>”、“<”或“=”)。
(4)溶液④加热后碱性增强,结合化学用语解释原因:_________。
(5)常温下,下列关于溶液②的判断正确的是_________。
a.c(CH3COO) = 0.1 mol/L
b.溶液中c(H+) > c(CH3COO) > c(OH )
c.加入CH3COONa(s),c(H+)不变
d.滴入 NaOH 浓溶液,溶液导电性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)![]() C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
Ⅲ | 0.32 | 1.0 | 0 | 0 | |
Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示:
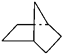
(1)写出其分子式____________。
(2)当降冰片烷发生一氯取代时,能生成_____________种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于______________________。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是__________________。
a.能溶于水 b.能燃烧 c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.l mol·L-1 H2C2O4溶液中滴加等浓度的NaOH溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列叙述正确的是( )
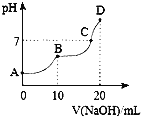
A.A点溶液中,c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-)
B.HC2O4-在溶液中水解程度大于电离程度
C.C点溶液中含有大量NaHC2O4和H2C2O4
D.D点溶液中,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g) ![]() H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
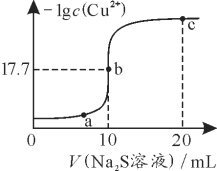
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com