
| A、1 | B、2 | C、3 | D、4 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、
| ||
| B、1-a% | ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成 |
| B、KClO3积SO3溶于水后能导电,故KClO3和SO3为电解质 |
| C、AgCl沉淀易转化为AgI沉淀且Ksp(AgX)=c(Ag+)?c(X-),故Ksp(AgI)<Ksp(AgCl) |
| D、沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g金属镁变为镁离子时失去的电子数为0.2NA |
| B、1mol?L-1KCl溶液中含有Cl-的个数为NA |
| C、常温常压下,22.4LCl2与足量的金属钠充分反应,转移电子数为2NA |
| D、标准状况下,22.4L的水中含有NA个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、168g | B、42g |
| C、126g | D、60g |
查看答案和解析>>
科目:高中化学 来源: 题型:
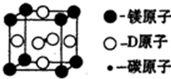 A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com