
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.分析 Ⅰ(1)根据化合物中化合价代数和为0计算;Na2S2O3在强酸性溶液中生成硫单质和二氧化硫;
(2)根据仪器构造和作用可得;
(3)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;根据检验硫酸根离子的方法检验杂质硫酸钠;
Ⅱ(4)滴定前溶液为无色,滴定结束后,碘单质使淀粉变蓝;
(5)依据化学反应方程式2S2O32-+I2═S4O42-+2I-计算.
解答 解:I (1)Na2S2O3 中钠元素化合价为+1加,氧元素化合价为-2价,化合物中化合价代数和为0,则硫元素的化合价为+2价;Na2S2O3在强酸性溶液中生成硫单质和二氧化硫,发生的反应为:S2O32-+2H+=S↓+SO2↑+2H2O;
故答案为:+2;S2O32-+2H+=S↓+SO2↑+2H2O;
(2)仪器a为:冷凝管,作用是冷凝回流乙醇;
故答案为:冷凝管;冷凝回流乙醇;
(3 )S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠;检验硫酸钠的方法为:取少量产品溶于过量稀盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;
故答案为:Na2SO4;取少量产品溶于过量稀盐酸,过滤,向滤液中滴加BaCl2溶液,若产生白色沉淀说明产品中含有Na2SO4;
II (4)滴定结束后,碘单质使淀粉变蓝,所以滴定终点时溶液颜色变化为:由无色变为蓝色,且半分钟内部褪色;
故答案为:由无色变蓝色,半分钟内不褪色;
(5)2S2O32-+I2═S4O62-+2I-,
2 1
x 0.100 0mol•L-1×20×10-3mL
解x=0.002mol,故Na2S2O3•5H2O的物质的量为0.002mol,质量为:0.002×248g/mol=0.992g,则W g产品的纯度为:$\frac{0.992}{W}×100%$;
故答案为:$\frac{0.992}{W}×100%$.
点评 本题考查化学实验制备,涉及仪器识别、离子的检验方法、氧化还原反应滴定与计算、离子方程式书写等,是对学生综合能力的考查,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
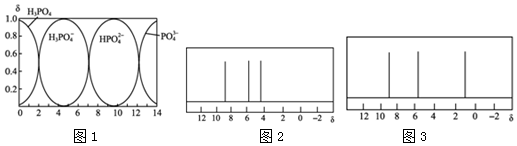
 ;分子M发生加聚反应产物的结构简式
;分子M发生加聚反应产物的结构简式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | -定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA | |
| C. | 将1molNH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| D. | 4.6g乙醇含有共价键的数目为0.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
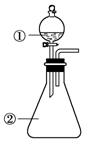 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| D | 饱和氯化铁溶液 | 浓氢氧化钠溶液 | 溶液呈红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的比例模型为  ,其二氯取代物有2种结构 ,其二氯取代物有2种结构 | |
| B. | 苯和乙烯都能使溴水褪色,其褪色原理相同 | |
| C. | 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同 | |
| D. | 在一定条件下,苯与氯气生成氯苯的反应类型是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
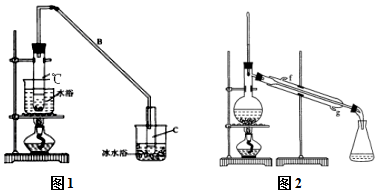 某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯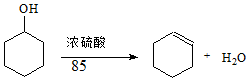
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③⑥ | C. | ①②⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com