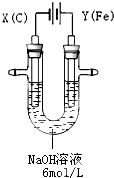
高铁酸钾(K
2FeO
4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
Ⅰ.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO
42-)在溶液中呈紫红色.
(1)电解过程中,X极是
阴
阴
极,电极反应是
2H++2e-=H2↑
2H++2e-=H2↑
.
(2)电解过程中,Y极放电的有
Fe和OH-
Fe和OH-
.
(3)生成高铁酸根(FeO
42-)的电极反应是
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
.
Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:Pb+PbO
2+2H
2SO
42H
2O+2PbSO
4,则它在充电时的阳极反应为
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
.
(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H
2O+2e
-=2Ni(OH)
2+2OH
-负极:Cd+2OH
--2e
-=Cd(OH)
2则它在放电时的总反应的化学方程式为
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
.
(3)肼(N
2H
4)是一种可燃性液体,可用作火箭燃料.已知在25℃、101kPa时,32.0g N
2H
4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N
2H
4完全燃烧的热化学方程式是
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
;肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是
N2H4+4OH--4e-=4H2O+N2↑
N2H4+4OH--4e-=4H2O+N2↑
.
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O
2和CO
2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C
3H
8+5O
2=3CO
2+4H
2O.
写出该电池正极的电极反应:
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.
(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是
10:10:5:1
10:10:5:1
.

 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.

 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH 溶液的pH为
溶液的pH为