【答案】
分析:(1)A.甲烷去掉一个氢原子不能得到CH
3+、CH
3-; B.CH
3+、CH
3-、CH
3-分别具有6个、7个和8个价电子,不是等电子体;
C.CH
3-与NH
3、H
3O
+均具有10个电子,互为等电子体;
D.CH
3+中的碳原子采取sp2杂化;
E.两个CH
3-或一个CH
3+和CH
3-结合都能得到CH
3CH
3.
(2)①Zn的原子序数是30,在第四周期,ⅡB 族,ds 区;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳);
③同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;[Zn(NH
3)
4]
2+中Zn
2+与N之间的化学键是配位键;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体.
解答:解:(1)A.甲烷分子变成CH
3+、CH
3-、CH
3-时,失去的分别是氢负离子、氢离子和质子,空间构型也不再与原来的分子相同,故A错误;
B.CH
3+、CH
3-、CH
3-分别具有6个、7个和8个价电子,不是等电子体,中心碳原子的价层电子对数不同,故空间构型不同,故B错误;
C.CH
3-与NH
3、H
3O
+均具有10个电子,互为等电子体,几何构型均为三角锥形,故C正确;
D.CH
3+中的碳原子采取sp2杂化,所有原子均共面,故D正确;
E.两个CH
3-或一个CH
3+和CH
3-结合可得到CH
3CH
3,故E正确.
故选CDE.
(2)①Zn的原子序数是30,其电子排布式为:1s
22s
22p
63s
23p
63d
104s
2,由电子排布式可知该元素为第四周期,第ⅡB族ds区,故答案为:四;ⅡB;ds;
②Zn
2+基态电子排布式为:1s
22s
22p
63s
23p
63d
10或[Ar]3d
10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),故答案为:1s
22s
22p
63s
23p
63d
10或[Ar]3d
10;sp
2、sp
3;
③配位体NH
3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH
3)
4]
2+中Zn
2+与N之间的化学键是配位键,故答案为:极性分子;
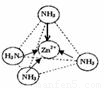
;
④晶胞中锌的个数为4,X的个数为4,化学式为ZnX,该化合物是立体网状结构是原子晶体,而干冰是分子晶体,故该化合物的熔点比干冰高得多,故答案为:ZnX;高,该化合物是原子晶体,而干冰是分子晶体.
点评:本题考查判断简单分子或离子的构型、极性分子、晶胞的计算、原子轨道杂化方式及杂化类型判断、晶体类型的判断等,难度较大,掌握晶胞的计算是解题的关键.


 ;
;

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案






 的结构简式
的结构简式
 ③-CH═CH2
③-CH═CH2
 +NaOH
+NaOH +NaCl+H2O
+NaCl+H2O +NaOH
+NaOH +NaCl+H2O
+NaCl+H2O
