甲醇是重要的化工原料,在日常生活中有着广泛的应用.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H
2(g)

CH
3OH(g)△H
1反应Ⅱ:CO
2(g)+3H
2(g)

CH
3OH(g)+H
2O(g)△H
2①在以上制备甲醇的两个反应中:反应I优于反应II,原因为
反应I符合“原子经济性”的原则即原子利用率为100%
反应I符合“原子经济性”的原则即原子利用率为100%
.
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数的数值:
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
I、在一密闭容器中发生反应Ⅰ并达到平衡后,保持其他条件不变,对容器升温,此反应的化学反应平衡应
逆向
逆向
移动(填“正向”、“逆向”、“不”).
II、某温度下,将1mol CO和4molH
2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为
80%
80%
,此时的温度
<
<
250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:①2CH
3OH(l)+3O
2(g)=2CO
2(g)+4H
2O(l)△H
1=-Q
1kJ/mol
②2CO (g)+O
2(g)=2CO
2(g)△H
2=-Q
2 kJ/mol③H
2O(g)=H
2O(l)△H
3=-Q
3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:
CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol
CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=(2Q3+0.5Q2-0.5Q1)kJ/mol
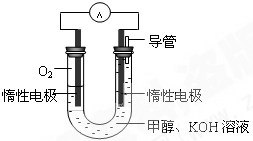
(3)某同学依据甲醇燃烧的反应原理,设计如图所示的电池装置,工作一段时间后,测得溶液的pH将
降低
降低
填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:
CH3OH-6e-+8OH-=CO32-+6H2O
CH3OH-6e-+8OH-=CO32-+6H2O
.

 (1)工业上一般采用下列两种反应合成甲醇:
(1)工业上一般采用下列两种反应合成甲醇:

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案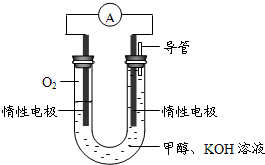 (2013?汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(2013?汕尾二模)能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景. 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.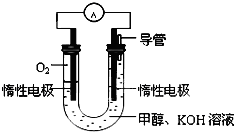 甲醇是一种可再生能源,具有广泛的开发和应用前景.
甲醇是一种可再生能源,具有广泛的开发和应用前景.