
【题目】下列表示戊烷燃烧热的热化学方程式正确的是( )
A. C5H12(l)+8O2(g)![]() 5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
5CO2(g) +6H2O(l) ΔH=-3 540 kJ·mol-1
B. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=-3 540 kJ·mol-1
C. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(g) ΔH=+3 540 kJ·mol-1
D. C5H12(l)+8O2(g)![]() 5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
5CO2(g)+6H2O(l) ΔH=+3 540 kJ·mol-1
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关。下列说法正确的是
A. 苏打是面包发酵粉的主要成分B. 汽油和乙烯均为石油分馏得到的产品
C. CaO可作工业废气的脱硫剂D. 蔗糖、淀粉、油脂的水解产物均为非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃的电池已成为重要的环境污染物,有资料表明一节废弃的镍镉电池可使1 m2面积的耕地失去使用价值,因此废旧电池必须集中回收处理,主要原因是( )
A. 回收其中的电极
B. 利用电池外壳的金属材料
C. 不使电池中渗出的电解液腐蚀其他物品
D. 防止电极中汞、镉、镍和铅等重金属离子对土壤和水源造成污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
A. 元素原子的最外层电子数等于元素的最高化合价
B. 多电子原子中,在离核较近的区域内运动的电子能量较高
C. P,S,Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D. 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:
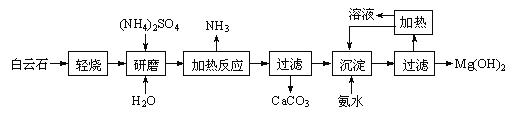
已知:①白云石加热过程中,固体失重百分比与温度的关系如下图所示:

② Ksp[Mg(OH)2]=5.61×10-12。
(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____(填化学式)。结合上图判断“轻烧”温度应不超过 _____。
(2)“加热反应”的化学方程式为_________________________。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______(已知)。
(4)该工艺中可以循环使用的物质是________(填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,从环境保护的用度分析,该工艺采用轻烧白云石的方法,其优点是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤烟气的脱硫(除SO2)技术和脱硝(除NOx)技术是环境科学研究的热点。下面是目前科学家正致力于研究的三种燃煤烟气脱硫和脱硝的方法。
(1)方法I:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。氨水吸收燃煤烟气中SO2的化学反应为:2NH3+SO2 + H2O=(NH4)2SO3 (NH4)2SO4+ SO2 + H2O=2 NH4HSO3
①为了提高燃煤烟气中SO2去除率,可以采取的措施有:使燃煤烟气与氨水充分接触和______。
②燃煤烟气中含有大量的CO2,但在脱硫过程中,不需要先除去燃煤烟气的CO2原因是___________。
(2)方法II:用电化学原理将SO2转化为重要的化工原料H2SO4进行脱硫,装置如图所示。

①写出通入SO2的电极的电极反应式:________。
②为使该脱硫过程稳定持续进行,硫酸溶液的浓度应维持不变,则通入的O2和加入的H2O的质量比为_________。
(3)方法Ⅲ:用乙烯作为还取剂将氨的氧化物还原为N2进行脱硝,其机理如图,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。


①写出该脱硝过程中乙烯和NO2反应的化学方程式:________________。
②如图,当负载率一定,达到某温度时脱硝率最高,而后却随着温度的升高脱硝率反而降低,其原因是__________;要达到最佳脱硝效果,应采取的条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素和淀粉遇碘水均显蓝色
B. 苯、乙酸和葡萄糖均属电解质
C. 溴乙烷与NaOH乙醇溶液共热生成乙烯
D. 乙酸乙酯和食用植物油均可水解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出图中序号①~④仪器的名称: 
(1)①;②;③;④;
(2)除去粗盐中的泥沙应选择装置 , 操作名称 .
(3)分离水和汽油的混合物应选择装置 , 操作名称 .
(4)除去淀粉溶液中的NaCl应选择装置 , 操作名称 .
(5)除去酒精溶液中的水应选择装置 , 操作名称 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料-铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)步骤1若改用稀硝酸,则Fe3O4发生反应的离子反应方程式为__;
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有____、玻璃棒和烧杯等;步骤Ⅳ中应选用__试剂调节溶液的pH(填字母编号).
A.稀硝酸 B.氢氧化钠溶液 C.高锰酸钾溶液 D.氨水
(3)检验步骤Ⅲ已经进行完全的试剂是__;
(4)步骤Ⅵ中发生反应的化学反应方程式为__;
(5)步骤Ⅴ中,FeCO3达到沉淀溶解平衡时,若室温下测得溶液的pH为9.5,c(Fe2+)=1×10﹣6 mol/L.试判断所得的FeCO3中是否含有Fe(OH)2, 并请通过简单计算说明理由______.(已知:Ksp[Fe(OH)2]=4.9×10﹣17)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com