|
传统制取甲醇的原理是 CO(g)+2H2(g) CH3OH(g)① CH3OH(g)①
25℃时,K=2.68×1022
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇.“绿色自由”构想技术流程如下:
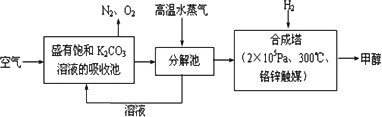
反应原理为①CO2(g)+3H2(g) CH3OH(g)+H2O(g)② CH3OH(g)+H2O(g)②
25℃时,K=3.96×1011
回答:
|
(1) |
|
相同条件下,反应①与反应②相比,转化率更大的是________,(用①②回答)
|
|
(2) |
|
(3) |
|
在30 MPa压强下,测得反应②的实验数据如下表.分析表中数据回答下列问题:

温度升高,K值________(填“增大”、“减小”、或“不变”).反应的ΔH________0(填>、=、<)
|
|
(4) |
|
下列措施中能使n(CH3OH)/n(CO2)增大的是________.(设合成塔为密闭容器)
|
A. |
升高温度
|
B. |
充入He(g)
|
C. |
将H2O(g)从体系中分离
|
D. |
再充入1 mol CO2和3 mol H2
|
|
(5) |
|
甲醇可制作燃料电池.写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________.
|
|
