
在80℃时,将0.4mol的A气体充入2L已抽空的固定容积的密闭容器中发生反应:A(g) mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
|
c(A) |
0.20 |
0.14 |
0.10 |
c |
d |
e |
|
c(B) |
0.00 |
0.12 |
b |
0.22 |
0.22 |
0.22 |
⑴m= ,表中b c(填“<”、“=”或“>”)。
⑵100秒后若将容器的体积缩小至原来一半,平衡时B的浓度____________0.44 mol/L(填“<”、“=”或“>”)。
⑶在80℃时该反应的平衡常数K值为 (保留1位小数)。
⑷在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②B的产量越大
③A与B的浓度之比越大 ④正反应进行的程度越大
⑴2,> ⑵< ⑶0.5, ⑷①③④
【解析】
试题分析:(1)反应进行到20s时,A、B的浓度变化量分别是0.06mol/L、0.12mol/L,所以m=2;则根据方程式可知2×(0.10-c)=0.22-b,解得b-2c=0.02,所以b大于c。
100秒后若将容器的体积缩小至原来一半,瞬间B的浓度是0.44mol/L,但平衡向逆反应方向移动,所以平衡时B的浓度小于0.44mol/L。
(3)根据表中数据可知,反应进行到60s时物质的浓度不再发生变化,则反应达到平衡状态,生成B的浓度是0.22mol/L,则A的浓度应该是0.20mol/L-0.11mol/L=0.09mol/L,所以平衡常数K=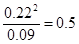
(4)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,据此可知,如果该反应的K值越大,表明建立平衡时A的转化率越高、B的产量越大、正反应进行的程度越大,但A与B的浓度之比越大越小,答案选①③④。
考点:考查外界条件对平衡状态的影响以及平衡常数的有关计算和应用
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和抽象思维能力,提高学生灵活运用基础知识解决实际问题的能力。


科目:高中化学 来源: 题型:
| 时间(s) C(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
| c2(NO2) |
| c(N2O4) |
| c2(NO2) |
| c(N2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)(mol) | 0.40 | a | 0.20 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
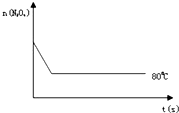 已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
已知N2O4(无色)?2NO2 (红棕色),在80℃时,将0.80mol的N2O4气体充入4L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n( N2O4 )(mol) | 0.80 | a | 0.40 | c | d | e |
| n(NO2)(mol) | 0.00 | 0.48 | b | 1.04 | 1.20 | 1.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s n/mol |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 30 | 60 | 90 |
| n(L)/mol | 0.80 | a | b | c |
| n(M)/mol | 0.00 | 0.10 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com