
【题目】根据题目提供的溶度积数据进行计算并回答下列问题:
(1)T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(![]() )=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
)=10-3 mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。
[已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________________________。
②完全沉淀后,溶液的pH=________。
③如果向完全沉淀后的溶液中继续加入50 mL 0.001 mol·L-1的盐酸,是否有白色沉淀生成?________(填“是”或“否”)。
【答案】是 蓝色 1.0×10-7mol·L-1 2 否
【解析】
(1) Ksp(CaCO3)=4.96×10-9 ,若c(CO32-)=10-3mol/L,则c(Ca2+)=4.96×10-9÷10-3=4.96×10-6<10-5 mol/L,所以Ca2+沉淀完全了;
(2) 25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据反应Mg(OH)2(s)![]() Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+)c(OH-)=10-14,可得c(H+)=
Mg2++2OH-可得:c(Mg2+)c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+)c(OH-)=10-14,可得c(H+)=![]() mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;
mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;
(3)①反应前,n(Ag+)=0.018 mol/L×0.05 L=9×10-4 mol,n(Cl-)=0.020 mol/L×0.05L=1×10-3 mol;反应后剩余的Cl-为1×10-4 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol/L,c(Ag+)=Ksp(AgCl)÷c(Cl-)=1.0×10-7 mol/L;
②H+没有参与反应,完全沉淀后,c(H+)=0.020mol/L÷2=0.010 mol/L,所以反应后溶液中pH=2;
③再向反应后的溶液中加入50mL0.001mol/L盐酸,由于加入盐酸中c(Cl-)与反应后溶液中的c(Cl-)相同,c(Cl-)不变,但c(Ag+)由于盐酸加入,溶液的体积增大而变小,所以Qc= c(Ag+) c(Cl-)<Ksp(AgCl),因此没有沉淀产生。


科目:高中化学 来源: 题型:
【题目】Ⅰ.按如图所示装置进行实验,并回答下列问题:

(1)甲池,通入CH3OH(甲醇)的电极反应式为______________________。
(2)乙池中的总反应化学方程式为______________________。
(3)当甲池中消耗O20.56L(标准状况下)时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出1.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
Ⅱ.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控利和治理是优化我们生存环境的有效途径。

(4)利用化学原理将C0、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO一极为____________________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为____________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子反应广泛用于化学研究、工业生产、食品检验、环境保护等方面。
(1)向0.01mol·L-1 Ba(OH)2溶液中匀速逐滴加入0.01mol·L-1 H2SO4溶液直至过量,整个过程中混合溶液的导电能力(用I表示)可近似地用下图中的____________(填字母)曲线表示,发生反应的离子方程式为__________________________________。

(2)提纯后的粗盐中,还含有MgCl2、Na2SO4和CaCl2等可溶性杂质,欲通过下列流程得到较纯净的NaCl固体。

①操作a、操作d均用到玻璃棒,作用分别是____________、____________。
②固体Ⅲ是________(填化学式),加入过量Z溶液的目的是________________。
③操作e的名称是____________________。
④检验制得的NaCl晶体中是否含有Na2SO4的方法是__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB27602011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用题图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。

(1)仪器A的名称是______________,水通入A的进口为________。(a/b)
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为__。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择题图中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________(酚酞/甲基橙);若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。

(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是

A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92 kJ/mol
2NH3 △H=-92 kJ/mol
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热不改变
D. 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为92kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上主要利用碳热还原重晶石制得硫化钡,进而生产各种钡化合物。下图为不同反应温度下,实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是
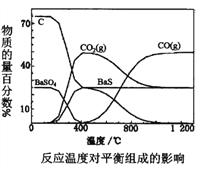
A. 约150℃,体系中开始出现BaS,说明温度越高反应速率越快
B. 400℃时发生的化学反应方程式: BaSO4+2C![]() BaS+2CO2
BaS+2CO2
C. CO—定无法还原重晶石
D. 温度高于400℃后,硫酸钡才能转化为BaS
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确定黄钾铁矾[KFe3(SO4)x(OH)y]的化学式,某兴趣小组设计了如下实验:

请回答:
(1)黄钾铁矾的化学式[KFe3(SO4)x(OH)y]中x=________,y=________。
(2)写出溶液B中所含溶质的化学式________。
(3)红褐色沉淀能溶于HI溶液,并发生氧化还原反应,写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把![]() L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用![]() mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗![]() molBaCl2,则原溶液中
molBaCl2,则原溶液中![]() (NO
(NO![]() )为( )
)为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·1-1
mol·1-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com