
美国“海狼”潜艇上的核反应堆内使用了液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A.原子半径:Na>Al
B.若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na)
C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小
D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成
科目:高中化学 来源: 题型:
下列说法正确的是
①元素原子的最外层电子数等于元素的最高化合价
②最外层一个电子的元素一定是金属元素,肯定在元素周期表的第IA族
③所有元素的原子最外层最多可容纳的电子数均为8
④第三周期元素随原子序数增大各非金属元素对应的氧化物的水化物酸性一定逐渐增强
⑤同主族元素随原子序数增大,其原子半径逐渐增大
A. ①②③④⑤ B. ①②③ C. ④⑤ D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,测得0.01mol/L NaOH溶液的PH为11,则该温度下,水的离子积Kw=_____________。在此温度下,将PH= a 的NaOH溶液Va L与PH= b 的硫酸Vb L混合。
①若所得溶液为中性,且a=12,b=2,则Va :Vb = __________________________
②若所得混合液的PH=10,且a=12,b=2,则Va :Vb = ______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2SO2+O2  2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
| 编号 | 改变的条件 | 生成的SO3的速率 |
| (1) | 升高温度 | |
| (2) | 充入一定量N2 | |
| (3) | 减少SO3的浓度 | |
| (4) | 使用催化剂 | |
| (5) | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 除去Fe2O3中的少量Al2O3 | 向混合物中滴加足量NaOH溶液,过滤 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸,过滤 |
| C | 证明钠的金属活动性比铝强 | 向AlCl3溶液中投入金属钠 |
| D | 实验室制备Al(OH)3 | 向Al2(SO4)3溶液中加入足量NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
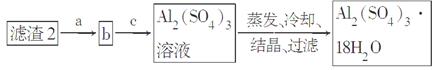
查看答案和解析>>
科目:高中化学 来源: 题型:
有关海洋中部分资源的利用的说法不正确的是( )

A.工业上利用Cl2与澄清石灰水反应制取漂白粉
B.用MgCl2·6H2O晶体制无水MgCl2,需在HCl气流中加热脱水
C.SO2水溶液吸收Br2的化学方程式为Br2+SO2+2H2O===H2SO4+2HBr
D.粗碘中混有少量ICl和IBr可加入KI进行升华提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________________________(用对应的元素符号表示);基态D原子的电子排布式为
______________________________________________________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC 的空间构型为________(用文字描述)。
的空间构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比是________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com