
【题目】下列各组中的离子,能在溶液中大量共存的是
A.Fe3+、Na+、Cl-、OH-
B.Fe3+、Cl-、K+、Ca2+
C.Cl-、Ca2+、Mg2+、CO32-
D.Ba2+、K+、CO32-、Cl-
科目:高中化学 来源: 题型:
【题目】气体的体积主要由以下什么因素决定的( )
① 气体分子的直径 ② 气体物质的量的多少
③气体分子间的平均距离 ④气体分子的相对分子质量
A. ①② B. ①③ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中不正确的是( )
A.过滤时,玻璃棒与三层滤纸的一边接触
B.过滤时,漏斗下端紧贴烧杯内壁
C.加热试管内物质时,试管底部与酒精灯外焰接触
D.向试管中滴加液体时,胶头滴管紧贴试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( )
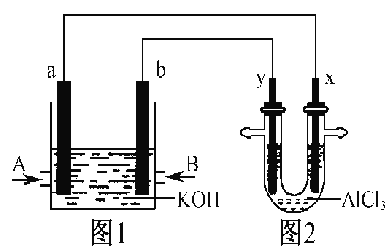
A. A处通入的气体为CH4,电极反应式为:CH4+10OH--8e-===CO32-+7H2O
B. 图2中电解AlCl3溶液的总反应为:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 图1中电解质溶液的pH增大
D. 电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某苯的同系物分子式为C8H10,若苯环上的氢原子被卤原子取代,生成的一卤代物有三种同分异构体,则该苯的同系物可能有( )
A. 4种 B. 3种 C. 2种 D. 1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示): ;
(2)混合溶液中由水电离出的c(H+) (填 “<”“>”或“=”)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH (填“<”“>”或“=”)7;
(4)将相同温度下相同浓度的五种溶液:①(NH4)2CO3 ②NH3·H2O ③(NH4)2SO4 ④NH4Cl ⑤CH3COONH4;按c(NH4+)由大到小的顺序排列 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017陕西黄陵】 磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式 。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x= (用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag+ + □ = □PO43-+ □Ag +□
(3)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下
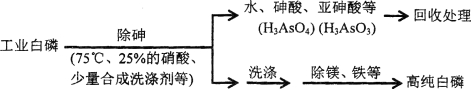
①除砷过程在75℃下进行,其合理的原因是_______(填字母)。
a.温度不宜过高,防止硝酸分解 b.适当提高温度,加快化学反应速率
c.使白磷熔化,并溶于水 d.降低白磷的毒性
②硝酸氧化除砷时被还原为NO,若氧化产物为等物质的量的亚砷酸与砷酸,则化学反应方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关工业生产的叙述不正确的是( )
A. 用海水淡化后的浓缩海水作原料提取溴
B. 在太阳能资源相对充足的沿海地区建造海水淡化厂
C. 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
A.水的密度;水的摩尔质量
B.水的质量;水的相对分子质量
C.水的体积;水中所含原子的数目
D.水的沸点;水分子的数目
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com