

装置最左端的圆底烧瓶盛放的物质是_____________,分液漏斗中盛放的物质是__________,硅胶的作用是_______________________________________;右边圆底烧瓶中的固体物质是_____________;装有H2O的试管中产生的现象和原因是_____________________________;最后一烧杯中应放的物质和作用是____________________________________________。
科目:高中化学 来源: 题型:
| b |
| t |
| b |
| t |
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高二上学期期中考试化学试卷(解析版) 题型:填空题
由于催化剂可以为化学工业生产带来巨大的经济效益,催化剂研究和寻找一直是受到重视的高科技领域。
(1)V2O5是接触法制硫酸的催化剂。下图为硫酸生产过程中2SO2
(g) + O2(g)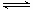 2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
2SO3(g)
ΔH=-196.6 kJ·mol-1反应过程的能量变化示意图。
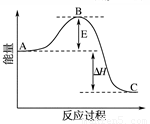
①V2O5的使用会使图中B点 (填“升高”、“降低”)。
②一定条件下,SO2与空气反应tmin后,SO2和SO3物质的量浓度分别为a mol/L和b mol/L,则SO2起始物质的量浓度为 mol/L;生成SO3的化学反应速率为 mol/(L·min)。
(2)下图是一种以铜、稀硫酸为原料生产蓝矾的生产流程示意图。
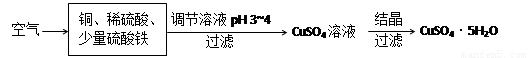
①生成CuSO4的总反应为2Cu+O2+2H2SO4=2 CuSO4+2H2O,少量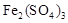 起催化作用,使反应按以下两步完成:
起催化作用,使反应按以下两步完成:
第一步:Cu+2Fe3+=2Fe2++Cu2+
第二步: 。(用离子方程式表示)
②调节溶液pH为3~4的目的是 ,调节时加入的试剂可以为 。(选填序号)
a.NaOH溶液 b.CuO粉末 c.Cu2(OH)2CO3 d.氨水
(3)纳米TiO2是优良的光敏催化剂。工业上用钛铁矿制得粗TiO2;再转化为TiCl4(l);由TiCl4(l)制取纳米TiO2的方法之一是将TiCl4气体导入氢氧火焰中(700~1000℃)进行水解。
已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
①写出TiO2和焦炭、氯气反应生成TiCl4和CO的热化学方程式: 。
②写出上述TiCl4(l)制取纳米TiO2的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川成都外国语学校高三10月月考化学卷 题型:填空题
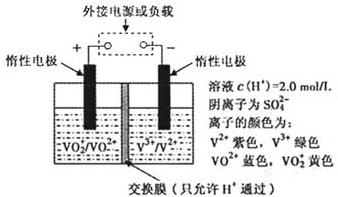
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域。V2O5是接触法制硫酸的催化剂。
(1) 一定条件下,SO2 与空气反应t min后,SO2 和SO3 物质的量浓度分别为a mol/L、b mol·L-1,则SO2 起始物质的量浓度为_________mol/L ;生成SO3的化学反应速率为_____________________。
(2)全钒液流储能电池是利用不同价态离子对氧化还原反应来实现化学能和电能相互转化的,其装置原理如下图:
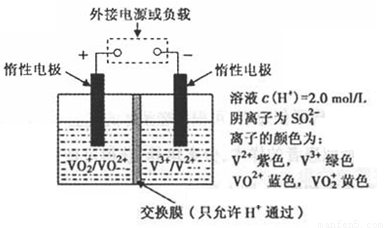
① 当左槽溶液逐渐由黄变蓝,其电极反应式为_______________________________。
② 充电过程中,右槽溶液颜色逐渐由__________色变为_______色。
③ 放电过程中氢离子的作用是________________和___________________________;充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)的变化量为______________。
查看答案和解析>>
科目:高中化学 来源:重庆市高考真题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com