
【题目】我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如下:
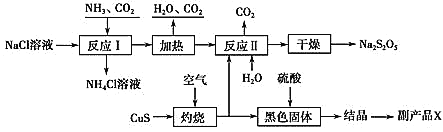
已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应。
(1) 反应Ⅰ的化学方程式为________;在进行反应Ⅰ时,向NaCl溶液中先通入_______(填“CO2”或“NH3”);
(2)“灼烧”时发生反应的化学方程式为__________;
(3)已知Na2S2O5与稀硫酸反应放SO2,其离子方程式为__________。
(4)副产品X化学式为________;生产中可循环利用的物质为____________(化学式)。
(5)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为_________,若气体量不足,则会导致___________________,检验产品中是否含有碳酸钠杂质,所需试剂是_________(填编号)。
①酸性高锰酸钾溶液 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH溶液 ⑥稀盐酸
【答案】NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl NH3 2CuS+3O2![]() 2CuO+2SO2 S2O52—+2H+═2SO2↑+H2O CuSO4·5H2O CO2 2:1 若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低 ①③⑥
2CuO+2SO2 S2O52—+2H+═2SO2↑+H2O CuSO4·5H2O CO2 2:1 若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低 ①③⑥
【解析】
根据侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程,饱和氯化钠溶液与二氧化碳、氨气反应生成碳酸氢钠,碳酸氢钠分解生成碳酸钠、水和二氧化碳,灼烧时, CuS与氧气反应生成黑色氧化铜和二氧化硫气体,把二氧化硫气体通入碳酸钠溶液生成NaHSO3,同时放出二氧化碳气体,2NaHSO3Na2S2O5+H2O,蒸干得到Na2S2O5固体。氧化铜与稀硫酸反应生成硫酸铜溶液,蒸发浓缩、冷却结晶、过滤、洗涤,得到硫酸铜晶体。
(1) 反应Ⅰ是饱和氯化钠溶液与二氧化碳、氨气反应生成碳酸氢钠和氯化铵,反应方程式为NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;在进行反应Ⅰ时,向NaCl溶液中先通入NH3,使溶液呈碱性,碱性条件下,能增大二氧化碳的溶解度;
(2)“灼烧”时,CuS与氧气反应生成黑色氧化铜和二氧化硫气体,发生反应的化学方程式为2CuS+3O2![]() 2CuO+2SO2;
2CuO+2SO2;
(3) Na2S2O5与稀硫酸反应生成硫酸钠、SO2、H2O,其离子方程式为S2O52-+2H+═2SO2↑+H2O。
(4) 氧化铜与稀硫酸反应生成硫酸铜溶液,蒸发浓缩、冷却结晶、过滤、洗涤,得到硫酸铜晶体,所以副产品X化学式为CuSO4·5H2O;根据流程图可知,生产中可循环利用的物质为CO2。
(5) Na2S2O5中钠与硫元素的原子数比是1:1,根据元素守恒,理论上需控制反应Ⅱ中SO2与固体Na2CO3反应物的物质的量之比为2:1;若SO2不足,Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加;检验产品中是否含有碳酸钠杂质,操作步骤是:取样品,加入足量稀盐酸,生成的气体通入足量的高锰酸钾溶液,除去二氧化硫,最后把气体通入澄清石灰水,若溶液变浑浊,则含有碳酸钠杂质,需要的试剂是①③⑥。


科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车常用蓄电池其结构如图所示,放电时反应如下: PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
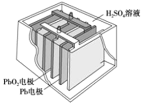
A.Pb 作为负极,失去电子,被氧化
B.电池放电时,溶液酸性增强
C.负极反应是 Pb+SO42-–2e-=PbSO4
D.PbO2 得电子,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变△H<0
B. 图中Z的大小为b<3<a
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)增大
(CH4)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减少二氧化碳排放,我国科学家设计熔盐电解池捕获二氧化碳的装置,如图所示。
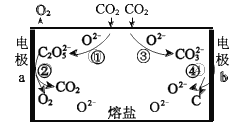
C2O52-可以表示为:[![]() ]2-,下列说法不正确的是
]2-,下列说法不正确的是
A.过程①中有碳氧键断裂
B.过程③中的反应可表示为:CO2+O2- = CO32-
C.过程②中 C2O52-在 a 极上发生了还原反应
D.过程总反应:CO2![]() C+O2
C+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)△H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
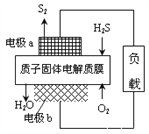
A. 电池在工作时,电流从电极a经过负载流向电极b
B. 电极a上发生的电极反应为: 2H2S - 4e- = S2 + 4 H+
C. 当反应生成64gS2时,电池内部释放632kJ热量
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个制取氯气并以氯气为原料进行特定反应的装置。
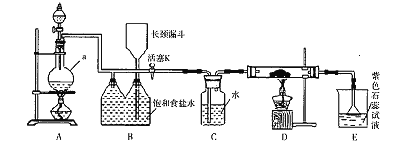
(l)A是氯气发生装置,写出其中的化学反应方程式___________。
(2)a仪器的名称为___________。
(3)实验开始时,先点燃A处的酒精灯,打开活塞K,让氯气充满整个装置,再点燃D处酒精灯,连接上E装置。D装置的硬质玻璃管内盛有炭粉,反应产物为CO2和HC1。写出D中反应的化学方程式_________,装置C的作用是__________。
(4)在E处,若漏斗内气体带有黄绿色,则紫色石蕊试液的颜色变化为_______。
(5)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___________(填序号)。
①有白色沉淀生成;②无白色沉淀生成;③先生成白色沉淀,而后白色沉淀消失。
(6)D处反应完毕后,关闭活塞K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,则装置B中的现象是________;若发现装置B中该现象不明显,可能的原因是________;查找原因时可用肥皂水或湿润的碘化钾淀粉试纸等,若用蘸有浓氨水的玻璃棒检查时观察到有白烟产生,写出该氧化还原反应的化学方程式_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com