


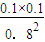 =
= ,
,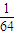 ;增大;
;增大;

科目:高中化学 来源: 题型:

| 1 |
| 64 |
| 1 |
| 64 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 1 |
| x |
| 3 |
| x |

查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省青岛市高三3月第一次模拟考试(第二套)理综化学试卷(解析版) 题型:填空题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)?? △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)?? △H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是????????????????????? 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量为0.6 mol反应中转移电子的数目为??????? ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
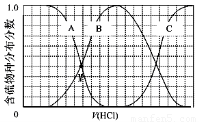
①B表示??? ??????????? 。
②滴加过程中,溶液中微粒浓度大小关系正确的是???? (填字母)。
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为??????????????????????????????????????? 。
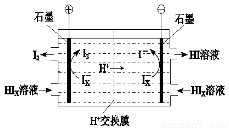
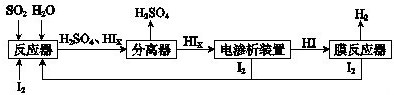
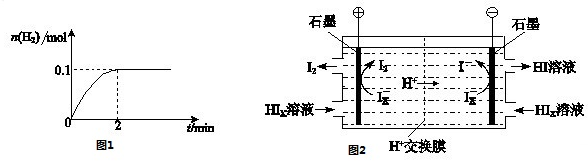
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
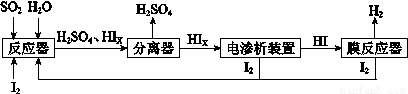
① 写出反应器中发生反应的化学方程式是?????????????????? 。
② 电渗析装置如图所示,写出阳极的电极反应式?????????????? 。该装置中发生的总反应的化学方程式是???????????????? 。
查看答案和解析>>
科目:高中化学 来源:西城区一模 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com