
| A、①② | B、①③ | C、①④ | D、①③④ |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
| A、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| B、需要加热的化学反应,生成物的总能量一定高于反应物的总能量 |
| C、熵减的反应一定是非自发反应 |
| D、己知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度(mol/L) | 反应后溶液的pH | |
| C(HA) | C(NaOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中C(Na+)>C(A-)>C(OH-)>C(H+) | ||
B、实验①反应后的溶液中C(OH-)=C(Na+)-C(A-)=
| ||
| C、实验②反应后的溶液中C(A-)+C(HA)=0.1 mol/L | ||
| D、实验②反应后的溶液中C(Na+)=C(A-)>C(OH-)=C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、定容时俯视液面 |
| B、转移溶液前溶液未冷却至室温 |
| C、容量瓶未干燥 |
| D、未洗涤烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 B:
B: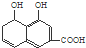
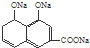 ,则应加入
,则应加入查看答案和解析>>
科目:高中化学 来源: 题型:
 在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:
在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)═CaO (s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线.请按要求回答下列问题:| 物质 | 电离平衡常数(25℃) |
| C6H5OH | Ki=1.28×10-10 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光合作用是自发反应 |
| B、所有自发进行的化学反应都是放热反应 |
| C、相同物质的量的同一物质在固、液、气三种状态时的熵值相同 |
| D、由能量判据和熵判据组合而成的复合判据,将更适合所有的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
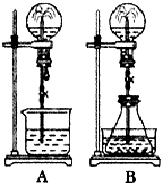 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com