
| 溶质 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 溶剂 | ||||
| 水 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| 170g |
| 170g/mol |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 某粉末加酒精润湿后,用玻璃棒蘸取做焰色反应 | 火焰呈黄色 | 该粉末中一定含有钠元素 |
| B | 在NaClO溶液中滴加酚酞试液 | 溶液最终呈无色 | ClO-在溶液中不水解 |
| C | 在Na2SiO3溶液中加入盐酸 | 白色胶状沉淀 | 非金属性:Cl>Si |
| D | 在NaOH溶液中加入少量AlCl3溶液 | 先生成白色沉淀,振荡后立即溶解 | 金属性:Na>Al |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CCl4萃取溴水中的溴,可观察到溶液分层,上层为橙红色,下层接近无色 |
| B、石油的裂化、煤的液化和煤的气化都属于化学变化 |
| C、热的苯酚浓溶液放入冷水中冷却,溶液变浑浊,此时发生了化学反应 |
| D、往蛋白质溶液里加入饱和的CuSO4溶液,可提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
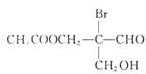 有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )
有机物若含手性碳原子(连接四个不同的原子或原子团的碳原子)就具有光学活性,如图物质发生下列反应后生成的有机物仍有光学活性的是( )| A、仅③ | B、仅①③ |
| C、仅②④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低 |
| B、常温下,某溶液中由水电离出的c(OH-)=1×10-10mol/L,该溶液一定呈酸性 |
| C、FeCl3溶液和Fe2(SO4)3溶液加热蒸干,灼烧都得到Fe2O3 |
| D、向饱和碳酸钠溶液中通入足量二氧化碳,可以析出纯碱晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com