
把NaHCO3和Na2CO3·10H2O混和物6.56g溶于水制成100mL溶液,其中c(Na+)=0.5mol/L。在该溶液中加入一定量盐酸恰好完全反应,将溶液蒸干后,所得固体质量为
A.2.93 g B.5.85 g C.6.56g D.无法确定
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源:2015-2016学年四川省雅安市高二上学期期中测试化学试卷(解析版) 题型:填空题
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20,且a+b+c=25; ②元素Y的原子价电子构型为ns2npn+2; ③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物; ④Z的硫化物的相对分子质量与Z氯化物的相对分子质量之比为38︰77。回答下列问题:
(1)X: (写元素名称);Z的价电子排布图为: 。
(2)X2Y2的电子式 ,属于 化合物(填“离子”或“共价”)。
(3)Z的硫化物的VSEPR模型为 ,分子空间构型为 ;Z的氯化物的VSEPR模型和分子空间构型分别是 、 ,其中Z原子分别以 杂化轨道成键,根据原子轨道成键方式分,Z的硫化物分子中含有的键的种类及数目是 、 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州市五校联盟高三12月月考化学试卷(解析版) 题型:选择题
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
下列有关说法错误的是
A.氧化性:Cr2O72->Fe3+>SO2
B.K2Cr2O7能将Na2SO3氧化成Na2SO4
C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上学期第二次月考化学试卷(解析版) 题型:选择题
氧化还原反应的实质是
A.氧元素的得与失 B.化合价的升降
C.电子的得失或偏移 D.分子中原子重新组合
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第二次月考化学试卷(解析版) 题型:选择题
下列溶液中与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是
A.150 mL 1 mol·L-1 的NaCl B.75 mL 2 mol·L-1 的NH4Cl
C.150 mL 3 mol·L-1 的KCl D.75 mL 2 mol·L-1 的CaCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高一下学期期中联考化学试卷(解析版) 题型:填空题
原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:

(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省商丘市高三上学期第二次模拟理综化学试卷(解析版) 题型:选择题
在实验室进行下列实验,括号内的实验仪器或试剂都能用到的是
A.中和热的测定(量筒、温度计、酒精灯)
B.从溴水中提取溴单质(分液漏斗、无水乙醇、玻璃棒)
C.探究浓硫酸与铜反应的产物(蘸有碳酸钠溶液的棉花团、蒸馏水、烧杯)
D.制氢氧化铁胶体(饱和FeCl3溶液、NaOH溶液、胶头滴管)
查看答案和解析>>
科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:填空题
甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)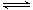 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)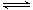 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为______热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从表中选择)。
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2?7)时,实验室利用下图装置模拟该法:
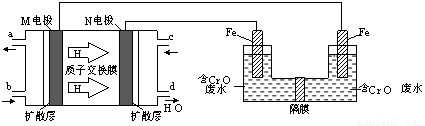
① N电极的电极反应式为 。
② 请完成电解池中Cr2O2?7转化为Cr3+的离子反应方程式:
Cr2O7 2?+ Fe2+ + [ ] ═= Cr3++ Fe3++ H2O
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5 mol•L﹣1 时,Cr3+沉淀完全,此时溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×10?31,lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com