
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
分析 反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数k=c(NH3)•c(HI)计算.
解答 解:平衡时c(HI)=4mol•L-1,HI分解生成的H2的浓度为0.5mol•L-1.则NH4I分解生成的HI的浓度为:4mol•L-1+2×0.5mol•L-1=5mol•L-1,故NH4I分解生成的NH3的浓度为5mol•L-1,
NH4I为固态,则反应①的平衡常数为:K=c(NH3)•c(HI)=5mol•L-1×4mol•L-1=20mol2•L-2,
故选C.
点评 本题考查化学平衡的计算,题目难度中等,正确计算分解的NH4I的物质的量浓度为解答关键,注意掌握化学平衡常数的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
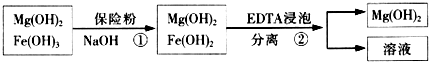
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
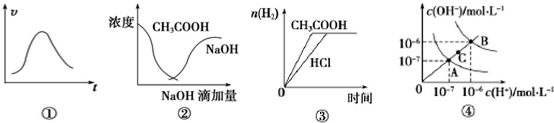
| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
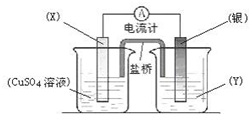 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
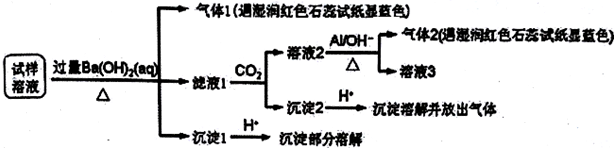
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
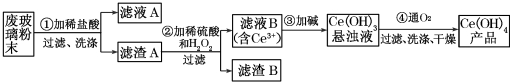
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
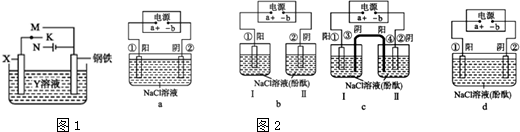
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com