
【题目】下列叙述中,不属于金属通性的是
A.易导电、导热B.有良好的延展性
C.溶沸点低D.有金属光泽
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】分类是学习化学的一种重要思想,下列关于物质的分类组合正确的是( )
分类组合 | 酸 | 碱 | 盐 | 酸性氧化物 | 碱性氧化物 |
A | 盐酸 | Na2CO3 | K2CO3 | CO2 | CaO |
B | 硝酸 | Ca(OH)2 | NaHSO4 | MgO | CO |
C | 硫酸 | 烧碱 | NaHCO3 | P2O5 | Na2O |
D | H2CO3 | Na2CO3 | CaCO3 | SO2 | CuO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,B、 D是中学化学常见金属,D在生活中应用最广泛。

(1)写出物质A与盐酸反应的离子方程式_____。
(2)探究A和B反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解, (假设固体全部溶解后溶液体积不变),反应过程中无气体放出 (活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如图所示:
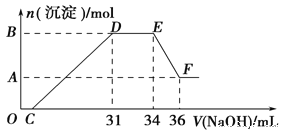
①写出DE段发生反应的离子方程式:_____。
②B与A的差值为_____mol。
③求c(HNO3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下发生下列反应:2X2O5 (g) ![]() 4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s | 0 | 50 | 100 | 150 |
c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (Ls)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
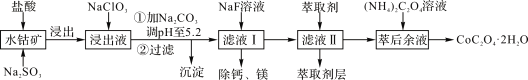
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→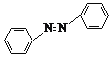 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的原因是_____________________________________。
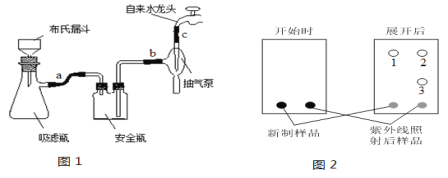
(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质,____________操作除去了可溶性杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半富马酸喹硫平可用于精神疾病的治疗,下图所示是其多条合成路线中的一条:
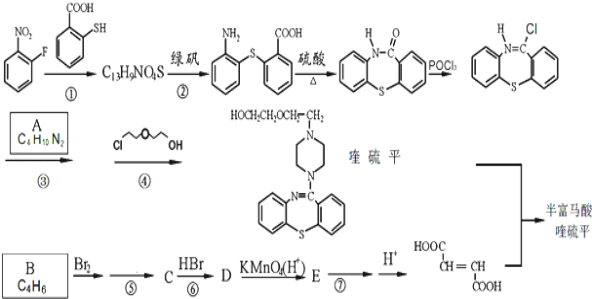
完成下列填空:
(1)反应①的反应类型是___________,反应⑤的试剂及反应条件是___________。
(2)写出结构简式:A___________; B___________。
(3)写出反应⑦的化学方程式_______________________________________________。
(4)写出反应③和④中生成的相同产物的化学式_________。反应⑤和⑦的目的是______________。
(5)化合物![]() 消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式_____________________________。
消去HCl后的产物记为F,写出两种F的能发生银镜反应、且只含3种不同化学环境氢原子的同分异构体的结构简式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。回答下列问题:
W | X | |||
Y | Z |
(1)四种元素简单离子的半径由大到小为_______(用离子符号表达)。
(2)W的最简单氢化物的电子式为______。
(3)Y单质与Fe2O3反应能放出大量的热,常用于焊接钢轨,该反应化学方程式为:________。Y的最高价氧化物与Z的气态氢化物的水溶液反应的离子方程式:__________。
(4)向盛有3 mL鸡蛋清溶液的试管里滴入几滴W的最高价氧化物的水化物浓溶液,实验现象为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】键能的大小可用于计算化学反应的反应热(△H)。
化学键 | Cl-Cl | H—H | H—Cl | N≡N |
键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g)= 2HCl(g)过程中,当生成1molHCl气体时需要___(填“吸收”或“放出” )____kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___kJ·mol-1。
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______(用含ΔH1、ΔH2、ΔH3的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com