
【题目】关于键长、键能和键角,下列说法不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长越长,共价化合物越稳定
D.键角的大小与键长、键能的大小无关
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在25℃时,将amol?L﹣1的氨水与0.01 mol?L﹣1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl﹣),用含a的代数式表示NH3?H2O的电离常数:Kb= ![]()
B.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ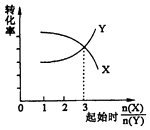
C.某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+
D.将10mL 1 mol?L﹣1Na2CO3溶液逐滴滴加到10mL1mol?L﹣1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl﹣)>c(CO32﹣)>c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学活动小组利用以下装置,制备LiH固体。
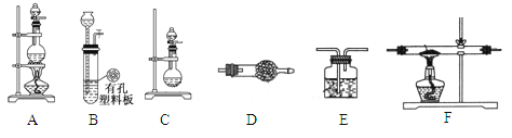
(1)元素锂在周期表中的位置 __________________。
(2)在LiH固体中比较离子半径大小关系r(Li+) _________r(H-)。(填“>”或“<”)
(3)活动小组准备利用上述部分装置制备LiH固体。可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰。已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是___________________(不必写出具体的操作方法);加入药品后,其中装置D的作用是____________________________。
②通入一段时间氢气后加热石英管,在加热F处的石英管之前,必须进行的实验操作是_______________________________。
③加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。完成LiH与水反应的化学方程式___________________________________。
④准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。在合适反应条件下,它们可以按下面框图进行反应;E溶液是无色溶液,F是淡绿色溶液,B和C反应发出苍白色火焰。请回答:
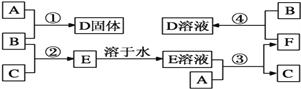
(1)A是_________,B是_________,C是_________![]() 填写化学式
填写化学式![]() ;
;
(2)反应①的化学方程式 ______________________________________;
(3)反应③的离子方程式 _____________________________________;
(4)反应④的离子方程式 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成题目:
(1)30%的H2SO4和50%的H2SO4等质量混合后,所得溶液的质量分数(填“大于”、“小于”或“等于”)40%,如果等体积混合,混合后溶液的质量分数(填“大于”、“小于”或“等于”)40%.
(2)已知98%的浓H2SO4的物质的量浓度为18.4molL﹣1 , 试判断49%的H2SO4的物质的量浓度(填“大于”、“小于”或“等于”)9.2molL﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com