
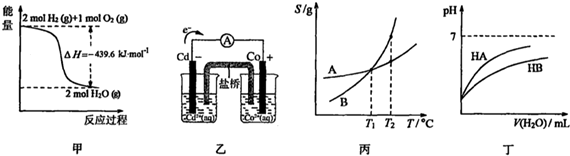
| A. | 由甲可知:氢气的燃烧热为219.8kJ/mol | |
| B. | 由乙可知:盐桥中的Cl-向Cd电极移动 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数:A=B | |
| D. | 由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其PH:NaA<NaB |
分析 A.1mol氢气完全燃烧生成液态水放出的热量为燃烧热;
B.原电池工作时阴离子向负极移动;
C.A、B饱和溶液在T1℃时溶解度相同,升高温度变成不饱和溶液;
D.酸越弱,其对应的盐水解程度越大.
解答 解:A.1mol氢气完全燃烧生成液态水放出的热量为燃烧热,甲图中生成的产物为气态水,所以不能计算燃烧热,故A错误;
B.Cd为负极,原电池工作时阴离子向负极移动,故B正确;
C.T1℃时,A和B的溶解度相同,饱和溶液中溶质的质量分数相同,当升温到T2℃时,两者的溶解度均变大,无晶体析出,故溶液中的溶质的质量分数均不变,仍相等,故C正确;
D.从图象可以看出,加水稀释时,HA的pH变化大,故HA的酸性强于HB,而酸越弱,其对应的盐越水解,故同温度、同浓度的NaA溶液与NaB溶液相比,NaB的水解程度大,pH更大,其pH前者小于后者,故D正确.
故选A.
点评 本题考查了图象的问题,涉及燃烧热、原电池原理、溶解度、盐的水解和弱电解质的电离等,题目具有一定的综合性,注意把握强、弱电解质稀释时pH的变化.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
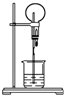 图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )
图为化学实验中常用的喷泉实验装置.在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体.下列组合中不可能形成喷泉的是( )| A. | SO2和H2O | B. | CO2和NaOH溶液 | C. | NH3和H2O | D. | NO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 糖类、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| D. | 明矾可以用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,阳极质量减少6.4g,电路中电子转移的总数为0.2NA | |
| B. | 6.0gSiO2晶体中含有0.2NA个Si-O键 | |
| C. | NA个CH4在标准状况下的体积约为22.4L | |
| D. | 苯与液溴反应生成1mol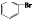 时消耗0.5NA个Br2 时消耗0.5NA个Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com