
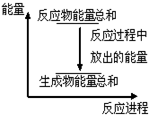
| A.反应过程中能量关系可用上图表示 |
| B.Zn和H2SO4的总能量大于ZnSO4和H2的总能量 |
| C.若将该反应设计成原电池,锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极要放出11.2L气体 |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.凡是伴有能量的变化都是化学变化 |
| B.反应物的总能量高于生成物的总能量时,发生放热反应 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.单质A转化为单质B是一个吸热过程,可知单质B比单质A稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
B.从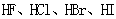 酸性递增的事实,推出 酸性递增的事实,推出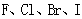 的非金属性递增的规律 的非金属性递增的规律 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.在压强相同条件下,结构相似的CH4、SiH4、GeH4的沸点依次升高,所以结构相似的HF、HCl、HBr、HI的沸点也依次升高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑥⑦⑩ | B.①③⑤⑦⑧ |
| C.①④⑤⑦⑧⑨ | D.①③⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.炼铁高炉的高度不够 | B.CO与铁矿石接触不充分 |
| C.CO过量 | D.CO与Fe2O3的反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
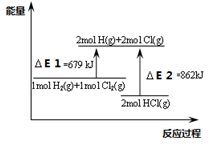
| A.△E1是该反应的活化能 |
| B.△E2是破坏2mol HCl(g)所需的能量 |
| C.该反应的热化学方程式为H2+Cl2=2 HCl△H=-183KJ/mol |
| D.该反应是一个反应物总能量高于生成物总能量的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 定反应过程中所放出的热量可计算中和热。试回答下列问题。
定反应过程中所放出的热量可计算中和热。试回答下列问题。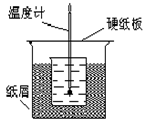
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com