
科目:高中化学 来源:不详 题型:单选题
 CO2↑+Mn2++□。下列有关叙述正确的是 ( )
CO2↑+Mn2++□。下列有关叙述正确的是 ( )| A.发生还原反应的是C2O |
| B.该离子方程式右侧方框内的产物是OH- |
| C.8 mol H+参加反应时,电子转移5 mol |
| D.草酸分子只中只含有极性共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
| 编号 | 1 | 2 | 3 |
| 混合物质量/g | 4.36 | 5.54 | 9.81 |
| 硫酸溶液体积/mL | 50.00 | 50.00 | 50.00 |
| 生成SO2的物质的量/mol | 0.03 | 0.0375 | 0.03 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
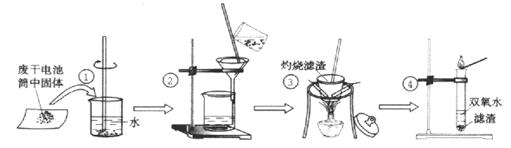
 其空白处的内容:
其空白处的内容:| 实验目的 | 操作 | 实验现象 | 结论 |
| 1、检验Cl— | 取少许滤液于试管中, | | 含有Cl— |
| 2、检验NH4+ | 取少许滤液于试管中, | | 含有NH4+ |
| 3、检验Zn2+ | 取少许滤液于试管中,加入 稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 编号 | 陈述I(原因) | 陈述II(结果) |
| A | O3能吸收紫外线 | 高空中得O3层被称为地球的保护伞 |
| B | 向100ml0.1mol/L的AlCl3溶液中加入1.5g NaOH发生反应 | Al(OH)3会完全溶解 |
| C | 钠原子核外电子数比铝少 | 钠的金属性比铝强 |
| D | HClO和SO2都具有漂白性 | 将Cl2和SO2同时 通入品红溶液,品红褪色会更快 通入品红溶液,品红褪色会更快 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3Fe+4CO2的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原。
3Fe+4CO2的反应中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 Fe 可知,欲实现I反应过程应从___________ (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
Fe 可知,欲实现I反应过程应从___________ (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。 下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )
下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )


 + ="==== " +
+ ="==== " +  4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com