
| A. | 碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质 | |
| B. | 碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质 | |
| C. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 | |
| D. | 水难电离,纯水几乎不导电,所以水是非电解质 |
分析 A、碳酸钙溶于水的部分完全电离,碳酸钙为强电解质;
B、碳酸钙溶于水的部分完全电离,碳酸钙为强电解质;
C、氯气为单质,不属于电解质和非电解质;氨气不能电离出离子;
D、水能够电离出氢离子和氢氧根离子,水为弱电解质.
解答 解:A、电解质强弱与溶液导电性没有必然关系,强弱电解质的根本区别在于能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,故A错误;
B、强弱电解质与溶解度大小没有必然关系,关键看电解质能否完全电离,碳酸钙溶于水的部分完全电离,所以碳酸钙为强电解质,故B正确;
C、氯气为单质,所以既不是电解质,也不是非电解质;氨气的水溶液导电,导电的离子是一水合氨电离的,不是氨气本身电离的,所以氨气为非电解质,故C错误;
D、水的导电性与水中离子的浓度有关;水难电离,但能电离,所以水是弱电解质,故D错误,
故选B.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断、溶液导电性强弱判断,题目难度中等,注意明确电解质与非电解质、强电解质与弱电解质的概念及根本区别,明确影响溶液导电性的根本因素、导电性与强弱电解质没有必然关系.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案科目:高中化学 来源: 题型:选择题
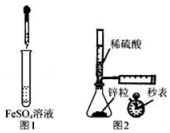
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 中和热测定实验中把盐酸分多次加入氢氧化钠溶液中 | |
| D. | 酸碱中和滴定实验中锥形瓶需要用待测液润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
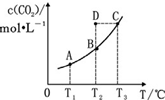 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )| A. | 反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在 T2时,若反应处于状态 D,则有 v 正<v 逆 | |
| C. | 平衡状态 A 与 C 相比,平衡状态 A 的 c(CO)小 | |
| D. | 若 T1、T2时的平衡常数分别为 K1、K2,则 K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在16g18O2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目少于NA个 | |
| D. | 12gMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol•L-1 的 H2SO4 溶液 pH=1 | |
| B. | 0.001 mol•L-1 的 NaOH 溶液 pH=ll | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合后溶液pH为5,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要PH=11的NaOH溶液50mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com