
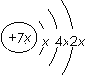 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为  。下列比较中正确的是( )
。下列比较中正确的是( )| A.原子半径:a>c>d>b | B.非金属性 b>d>c |
| C.原子序数:d>a>c>b | D.最高价含氧酸的酸性c>d>a |
科目:高中化学 来源:不详 题型:单选题
| A.①③ | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10—7 K2=4.7×10—11 | K=1.75×10—5 |
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | | |||||
| 2 | | | | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该元素为Mn元素 | B.该元素原子核外有4个能层 |
| C.该元素原子最外层共有7个电子 | D.该元素属于d区元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com