
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊 | 该溶液中一定有CO32- |
| D | 用洁净的铂丝蘸取某溶液,在无色火焰上灼烧,观察到火焰颜色为黄色 | 该溶液中一定含有Na+,可能含有K+ |
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:不详 题型:填空题
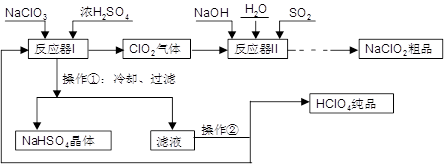
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
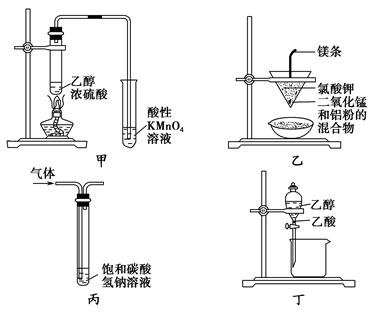
| A.甲图所示装置可以检验有乙烯生成 |
| B.乙图所示装置可以制取金属锰 |
| C.丙图所示装置用来洗气,除去CO2中的HCl气体 |
| D.丁图所示装置用来分离乙醇和乙酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.二氧化碳中混有SO2(饱和NaHCO3溶液) |
| B.氮气中混有氧气(灼热的铜网) |
| C.NaNO3溶液中混有Na2SO4〔Ba(NO3)2溶液〕 |
| D.氨气中混有水蒸气(浓硫酸) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓, 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O| | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。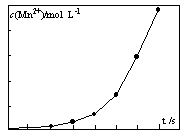
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 在水中溶解性 |
| 甲苯 | -95 | 110.6 | 0.8669 | 难溶 |
| 苯甲酸钾 | 121.5~123.5 |  |  | 易溶 |
| 苯甲酸 | 122.4 | 248 | 1.2659 | 微溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com