
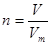 可知
可知

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
 L(标准状况)CO中所含氧原子数目相同,则m的数值是( )
L(标准状况)CO中所含氧原子数目相同,则m的数值是( )A.17 /22.4 /22.4 | B.28 /22.4 /22.4 | C.34 /22.4 /22.4 | D.14 /22.4 /22.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该溶液物质的量浓度为10 mol· L-1 |
| B.该溶液物质的量浓度因溶液的密度未知而无法求解 |
| C.该溶液中溶质的质量分数因溶液的密度未知而无法求得 |
| D.所得溶液的体积为22.5 L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)
设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:H 1,N 14)| A.1.8g的NH4+离子中含有nA个电子 |
| B.标准状况下,22.4L水中含有nA个H2O分子 |
| C.常温常压下,33.6 L Cl2中含有1.5nA个C12分子 |
| D.1 mol·L-1 Na2SO4溶液中有2nA个Na+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.温度相等、体积相同的O2和N2 | B.压强相同、体积相同的 O2和N2 |
| C.体积相等、密度相等的CO和C2H4 | D.质量相等、密度不等的N2和CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所用NaOH已经潮解 | B.有少量NaOH溶液残留在烧杯里 |
| C.向容量瓶中加水定容时俯视 | D.称量时误用“左码右物” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com