
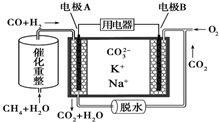
| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
分析 甲烷和水经催化重整生成CO和H2,反应中C元素化合价由-4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32-,以此解答该题.
解答 解:A.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32--4e-=H2O+3CO2,有二氧化碳生成,故A正确;
B.正极为氧气得电子生成CO32-,反应为O2+2CO2+4e-=2CO32-,故B正确;
C.反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,反应中C元素化合价由-4价升高到+2价,每消耗1molCH4转移6mol 电子,故C正确;
D.熔融碳酸盐为电解质,应在高温下进行工作,常温下不能形成原电池,故D错误.
故选D.
点评 本题为2015年江苏考题第10题的改编题,考查了化学电源新型电池,明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,难度中等.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①③④⑦⑧ | C. | ②③④⑤⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
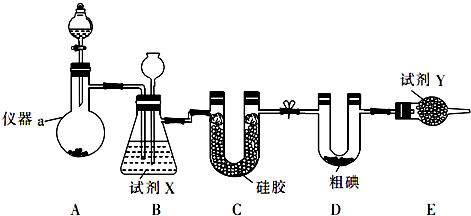
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
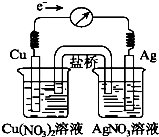 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
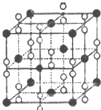 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的种类由核外电数决定 | |
| B. | 原子的种类由原子核内质子数与中子数共同决定 | |
| C. | 难失电子的原子,得电子的能力-定强 | |
| D. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向KCl溶液中滴加几滴酚酞试液,溶液颜色变红 | |
| B. | 向KI溶液中通入适量Cl2后,溶液颜色变深 | |
| C. | 溴水与NaCl溶液混合时,会发生置换反应 | |
| D. | NaCl溶液在空气中会被氧化,故需要密封保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com