

���� ��1����ͼ�����X��Ũ�ȱ仯�����ݷ�Ӧ����v��X��=$\frac{��c��X��}{��t}$���㣻
��2��t4��t5�����淴Ӧ���ʼ�С����ȣ�����ǽ����¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ�����Y��XŨ�ȵı仯�ж϶���������ϵ������t4��t5���жϻ�ѧ����ʽ����ͼ�ҿ�֪t2ʱ������ijһ���ʵ�Ũ�ȣ���֪t2-t3�Σ�Y�����������С����������Z��Ũ�ȣ�����ƽ���ƶ����ж����淴Ӧ���ʵĹ�ϵ��
��3���ɣ�2��������֪t4��t5�θı������Ϊ��Сѹǿ����ʱƽ�ⳣ�����䣻
��4����������1molZ��Ӧ�������仯����Ϸ���ʽ��д�Ȼ�ѧ����ʽ������ʱƽ�������ƶ���ƽ�ⳣ������
��5������ƽ�ⳣ������������´ﵽƽ��ʱ����ֵ�Ũ�ȣ�����X�ļ�С�������ɼ���X��ת���ʣ�
��� �⣺��1��ͼ����t0��t1��XŨ�ȱ仯Ϊ0.15mol/L-0.06mol/L=0.09mol/L��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊv��X��=$\frac{��c��X��}{��t}$=$\frac{0.09mol/L}{5min}$=0.018 mol•L-1•min-1��
�ʴ�Ϊ��0.018 mol•L-1•min-1��
��2��t3��t4����t4��t5�����淴Ӧ���ʶ���ȣ���t3��t4��Ϊʹ�ô��������t4��t5�θı������Ϊ���ͷ�Ӧ�¶ȣ�ƽ���ƶ������ƶ��������淴Ӧ���ʲ���ȣ���t4��t5��ӦΪ��Сѹǿ����Ӧ��X��Ũ�ȱ仯Ϊ0.15mol/L-0.06mol/L=0.09mol/L��Y��Ũ�ȱ仯Ϊ0.11mol/L-0.05mol/L=0.06mol/L����Ӧ��X��Y�ļ�����֮��Ϊ0.09��0.06=3��2����÷�Ӧ������Ļ�ѧ������֮��ǰ����ȣ����У�3X��g��?Z��g��+2Y��g����
��ͼ�ҿ�֪t2ʱ������ijһ���ʵ�Ũ�ȣ���֪t2-t3�Σ�Y�����������С����������Z��Ũ�ȣ�����Z��Ũ��ƽ�����淽���ƶ�������v��С��v�棻
�ʴ�Ϊ������
��3���ɣ�2������֪t4��t5�θı������Ϊ��Сѹǿ��t2��t3��Ϊ�������Ũ�ȣ�t5��t6�����淴Ӧ���ʾ���ͻ�䣬Ϊ�ı��¶ȣ�����t4��t5�ε�ƽ�ⳣ������t2��t3�ε�ƽ�ⳣ��K=$\frac{c��Z��•c��Y��^{2}}{c��X��^{3}}$=$\frac{0.05mol/L����0.11mol/L��^{2}}{��0.06mol/L��^{3}}$=2.8��
�ʴ�Ϊ����Сѹǿ��2.8��
��4��t5��t6��������Z�����ʵ���������0.10mol���ڷ�Ӧ�������仯����Ϊa kJ��������1molZ�������仯Ϊ10a kJ�����ڽ���Z�������ӣ�����ӦΪ���ȷ�Ӧ��
���Ը÷�Ӧ���Ȼ�ѧ����ʽ3X��g��?2Y��g��+Z��g����H=-10a kJ/mol������ʱƽ�������ƶ���ƽ�ⳣ���������Ԣ�ʱƽ�ⳣ�����
�ʴ�Ϊ��3X��g��?2Y��g��+Z��g����H=-10a kJ/mol������
��5��3X��g��?2Y��g��+Z��g��
��ʼ����mol��0.6 0.2 0.08
�仯����mol��3a 2a a
ƽ������mol��0.6-3a 0.2+2a 0.08+a
��ƽ�ⳣ��K=$\frac{��\frac{0.2+2a}{V}��^{2}����\frac{0.08+a}{V}��}{��\frac{0.6-3a}{V}��^{3}}$=2.8��a=0.12����Ӧ��ƽ��״̬��X��ת����=$\frac{3��0.12mol}{0.6mol}��100%$=60%��
�ʴ�Ϊ��60%��
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬�ѶȽϴ�ע�����ͼ�жϸ��ε�Ӱ�����أ���Ϊ������Ĺؼ����״���Ϊ����Ӱ�����أ�


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
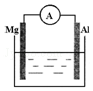 ��ͼ��ʾװ���У�����þ�����͵�����ͨ������������
��ͼ��ʾװ���У�����þ�����͵�����ͨ�������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
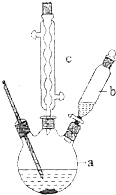 ���������л��ϳɵ��м�������������һ��ʵ���Һϳ�·�ߣ�
���������л��ϳɵ��м�������������һ��ʵ���Һϳ�·�ߣ�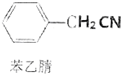 +H2O+H2SO4$\stackrel{100��130��}{��}$
+H2O+H2SO4$\stackrel{100��130��}{��}$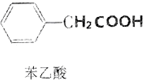 +NH4HSO4
+NH4HSO4�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
| n��PCl3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ͼΪʵ�������屽��ʵ��װ��ͼ�������ͼ�ش���������
ͼΪʵ�������屽��ʵ��װ��ͼ�������ͼ�ش��������� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ����̼���á��ѳ�Ϊ��ѧ���о�����Ҫ����֮һ��
����̼���á��ѳ�Ϊ��ѧ���о�����Ҫ����֮һ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
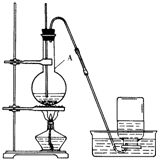
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
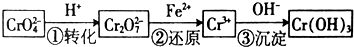
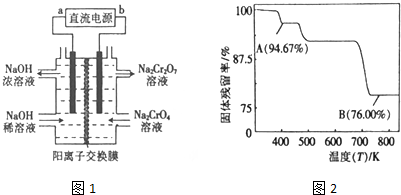
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com