
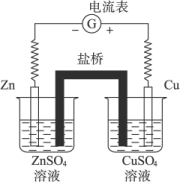
在两个烧杯中分别放入锌片和锌盐溶液、铜片和铜盐溶液,用盐桥(如充满KCl饱和溶液和琼脂制成的胶冻)连接两烧杯中溶液,再用导线将锌片和铜片连接,并在导线中串联一个电流计,可以观察到什么现象?
|
首先明确课本中所讲的原电池,是为了便于说明原电池化学原理的一种简单的装置.如果用它作电源,不但效率低,而且时间稍长电流就不断减弱,因此不适合实际应用.原因是由于在铜极上很快就聚集了许多氢气泡,把铜极跟稀硫酸逐渐隔开,这样就增加了电池的内阻,使电流不能畅通.为避免发生这种现象,设计如上图所示的原电池装置. 其次原电池在反应一定时间后,溶液会因带电离子的积累(ZnSO4溶液中Zn2+离子过多,CuSO4溶液中 该装置是原电池装置,之所以能够形成原电池,是因为锌比铜活泼,容易失去电子变成Zn2+,进入溶液,电子通过导线流向铜片,硫酸溶液中的Cu2+从铜片上获得电子变成铜原子沉积在铜片上,盐桥起着离子通道作用.故可以观察到下列现象: (1)电流表指针发生偏转,根据指针偏转方向,可以判断锌片为负极,铜片为正极. (2)铜片上有铜析出,锌片则被溶解. (3)取出盐桥,指针回到零点,说明盐桥起了沟通电路的作用. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高一化学(上) 题型:021
在托盘天平的两个盘上分别放上等质量的烧杯,调节天平平衡,在两个烧杯中分别放入等浓度、等质量的稀盐酸,再分别加入质量比为23∶24的钠和镁,充分反应后,下列说法正确的是
[ ]
A.若盐酸过量,则天平仍平衡
B.若盐酸过量,则放钠的一端重
C.若盐酸不足,则放镁的一端重
D.若盐酸不足,则放镁的一端轻
查看答案和解析>>
科目:高中化学 来源: 题型:021
在托盘天平的两个盘上分别放上等质量的两个烧杯,调节天平平衡,在两个烧杯中分别放上等浓度、等质量的稀盐酸,再分别放入相等物质的量的镁和铝,充分反应后,下列说法中错误的是
[ ]
A.若盐酸不足,则天平仍平衡
B.若盐酸不足,则放入铝的一端重
C.若盐酸过量,则放入镁的一端重
D.若盐酸过量,则放镁的一端轻
查看答案和解析>>
科目:高中化学 来源:化学(高一上)单元同步1+1测试卷 题型:021
在托盘天平的两个盘上分别放上等质量的两个烧杯,调节天平平衡,在两个烧杯中分别放上等浓度、等质量的稀盐酸,再分别放入相等物质的量的镁和铝,充分反应后,下列说法中错误的是
[ ]
A.若盐酸不足,则天平仍平衡
B.若盐酸不足,则放入铝的一端重
C.若盐酸过量,则放入镁的一端重
D.若盐酸过量,则放镁的一端轻
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
小明等同学为了探究酸、碱、盐溶液的导电性,设计了如下实验:
1.在5只250mL烧杯分别加入浓度均为0.1mol·L-1的盐酸、CH3COOH溶液、NaOH溶液、NaCl溶液、氨水各150mL。
2.在5种溶液中分别放入相同规格的石墨电极,按下图连接好。

3.接通电源,仔细观察现象。
现象1:五个灯泡都亮起来。
结论: 。
现象2:盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,醋酸、氨水对应的灯泡较暗。
结论: 。
思考:
1.酸、碱、盐溶液导电与金属导电的原理是否相同,为什么?
2.同学们为了探究不同电解质之间电离能力的差异,设计了上述实验,通过观察灯泡的明亮程度,判断电解质的电离能力大小,为此必须控制其他能影响灯泡亮度的一些因素,使之保持一致,从而不影响灯泡的明亮程度。在本实验中,采取了哪些主要措施来控制其他因素对灯泡亮度的影响?(写出三条即可) 。
3.小明同学根据现象2得出一个结论:氯化氢、氯化钠、氢氧化钠是强电解质,醋酸、一水合氨是弱电解质。你同意他这个观点吗?为什么?
。
4.为了进一步探究氯化氢等化合物是强电解质,小红同学在老师的帮助下测定了0.1mol·L-1的盐酸中的氢离子浓度,通过对结果的分析,即可得出结论。说明氯化氢是强电解质的理由是:测得溶液中的氢离子浓度 0.1mol·L-1(选填>、<、=)。
5.同学们在实验的基础上,进一步查阅资料得知:一般来说, 是强电解质, 是弱电解质。根据以上结论推测:如果将上述实验中的醋酸和氨水混匀,然后分别盛放在原来的烧杯中。接通电源,可以观察到的现象是:
A.与混合前无任何区别。
B.5只灯泡都亮起来,亮度完全相同。
C.只有盐酸、氯化钠、氢氧化钠溶液对应的灯泡亮起来,另外两只不亮。
D.5个灯泡都亮起来,盐酸、氯化钠、氢氧化钠溶液对应的灯泡较亮,另外两只略暗,但明显比混合前明亮。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com