
| A.常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1 |
| B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同 |
| C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |


科目:高中化学 来源:不详 题型:单选题
| A.CaCl2═Ca2++2Cl- | B.K2CO3═K2++CO32- |
| C.Ba(OH)2═Ba2++(OH)2- | D.FeCl3═Fe2++3Cl- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若a≤b,混合液的pH一定小于7 |
| B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立 |
| D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等温等物质的量浓度溶液中,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大 |
| B.0.2 mol/L NH4Cl溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)= c(S2-)+ c(HS-)+ c(H2S) |
| D.同浓度的下列溶液中:①NH4Al(SO4) 2②NH4Cl③CH3COONH4④NH3·H2O,c(NH4+)由大到小的顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.HA是强酸 |
| B.该混合液pH=7 |
| C.图中x表示HA,Y表示OH-,Z表示H+ |
| D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B.在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C.加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D.铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
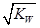 B. 混合液中:c(HA)+c(A-)=a mol·L-1
B. 混合液中:c(HA)+c(A-)=a mol·L-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com