
【题目】下列关于元素周期表的说法正确的是
A.第 IA 族的所有元素都是金属元素
B.同周期主族元素中,第ⅦA 族元素原子半径最小
C.稀有气体元素原子的最外层电子数均为 8
D.元素周期表共有 7 个周期,18 个族
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法中不正确的是( )
A. 在元素周期表中共有7个周期
B. 元素周期表中有三个短周期
C. 第二周期共有8种元素
D. 第三周期元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
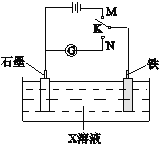
A. K与N连接时,X为硫酸,一段时间后溶液的pH增大
B. K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑
C. K与M连接时,X为硫酸,一段时间后溶液的pH增大
D. K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组对以下三种品牌牙膏中摩擦剂成分进行调查,结果如下表:
牙膏品牌 | A儿童牙膏 | B防臭牙膏 | C透明牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)上述三种摩擦剂成分中属于酸性氧化物的是________(填化学式,下同);既能与强酸反应又能与强碱反应的是________。
(2)A儿童牙膏中摩擦剂成分与NaOH溶液反应的离子方程式是______________________________。
(3)从摩擦剂成分考虑,向B防臭牙膏样品中滴加少量稀盐酸,可观察到的现象是______________________________________,该反应的化学方程式为_______________________。
(4)C透明牙膏摩擦剂成分SiO2是工业制备晶体硅的原料,其反应原理是_______________(用化学反应方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物的下列叙述中不正确的是
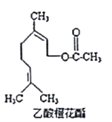
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗lmolNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③ B. ①②⑤⑥ C. ②④⑥ D. ②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
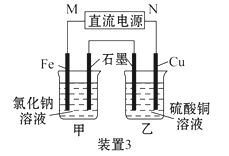
【题目】如图所示3套实验装置,分别回答下列问题:
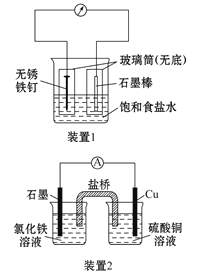
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______(填氧化、还原);向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为___________________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取、净化并收集氯气涉及以下几个主要阶段:
![]()
![]()
![]()
![]() 尾气处理
尾气处理
(1)写出实验室制取氯气的离子方程式____________________________,NA表示阿伏加德罗常数的值,若有4 mol的HCl被氧化,则转移的电子总数为______;将足量的MnO2投入含2 mol HCl的浓盐酸中,充分加热,可生成的Cl2________(填“>”“=”或“<”)0.5 mol。
(2)现有3种试剂可供选择:A.饱和食盐水 B.浓硫酸 C.NaOH溶液,则Y溶液应选用________(填字母),X溶液的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com