
(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
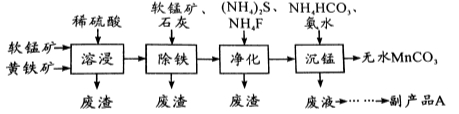
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol?L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
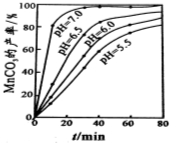
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol?L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是 。
副产品A的化学式是 。
32.(16分) (1)搅拌、适当升高温度、研磨矿石、适当提高稀硫酸的浓度(答一条,2分)
(2)使残余的Fe2+转化为Fe3+(2分)
(3)1.46×10-6 mol?L-1 (2分)
(4)pH等于7.0时反应速率最快,且MnCO3的产率最高(2分)
(5)Mn2++2HCO3- = MnCO3↓+CO2↑+H2O(3分)
(6)过滤、洗涤、干燥。(3分) (NH4)2SO4(2分)
【解析】
试题分析: (1)提高浸取率的措施可以是搅拌、适当升高温度、研磨矿石、适当增大酸的浓度等,任选一条。
(2)主要成分是FeS2 的黄铁矿在酸浸过程中产生亚铁离子,因此流程第二步除铁环节的铁应该转化铁离子才能更好除去,所以需要加入氧化剂软锰矿把Fe2+氧化为Fe3+,在加入石灰调节pH值使Fe3+完全沉淀。
(3)由于流程第二步加入了石灰引入了Ca2+ 杂质,因此除去溶液中的Cu2+、Ca2+等杂质可分别使用(NH4)2S和NH4F,生成CuS、CaF沉淀除去。根据已知氟化钙的溶度积和c(F-),可求c(Ca2+)= Ksp(CaF2)/ c2(F-)=1.46×10-6 mol?L-1 。
(4)从沉锰的图像可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高。
(5)沉锰工序的溶液中有Mn2+,加入碳酸氢铵,Mn2+会与HCO3-电离产生的CO32-结合成难溶的沉淀MnCO3 ,从而促进HCO3-进一步电离产生H+,一部分HCO3-又与电离得到的H+反应生成气体CO2,因此整个反应可以表达成Mn2++2HCO3- = MnCO3↓+CO2↑+H2O。
(6)从沉锰工序中得到纯净MnCO3,只需将沉淀析出的MnCO3 过滤、洗涤、干燥即可。得到的滤液中还有大量的铵根离子和硫酸根离子没有反应,因此可以制的副产品 (NH4)2SO4 。
考点:本题考查的是化学工艺流程题。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2013-2014广东省越秀区高一下学期学业水平测试调研化学试卷(解析版) 题型:选择题
下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是( )
A.6和8 B.19和16 C.12和17 D.10和8
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省、揭阳一中两校届高三5月三模化学试卷(解析版) 题型:简答题
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。

(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。





A B C D E
④ 滴定结果如下表所示:
滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
A.未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极
B.电镀时通过1mol电子,阴极上有0.5mol锌的析出
C.未通电前K+向铁极移动,通电后K+还向铁极移动
D.镀锌层破损后对铁制品失去保护作用
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中,能证明某物质是强电解质或弱电解质的是
A.某物质熔化时不导电,则该物质为弱电解质
B.某物质不是离子化合物,而是极性共价化合物,则该物质为弱电解质
C.某一元酸2 mol与足量Zn完全反应生成1 molH2,则该酸为强酸
D.溶液中已电离的离子和未电离的分子共存,则该物质为弱电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省湛江市高三年级第二次模拟理综化学试卷(解析版) 题型:选择题
常温下关于0.l mol·L-1氯化铵溶液的说法错误的是( )
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.加入氨水至pH=7, c(NH4+)>c(C1-)
C.滴加浓盐酸可能有,c(NH4+) = c(H+) D.加入少量CH3COONa固体,c(NH4+)减小
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:计算题
用足量的NaOH吸收448mLCl2(标准状况)氯气,计算生成NaCl的物质的量。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省第一学期期终考试高一级化学科试卷甲卷(解析版) 题型:选择题
下列溶液中溶质的物质的量浓度是1mol/L的是
A.将40g NaOH溶解于1L水中
B.将22.4LHCl气体溶于水中配成1L溶液
C.将1L 10mol/L 的浓盐酸与9L水混合
D.将10g NaOH溶于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高考预测理综化学试卷二(解析版) 题型:填空题
(本题16分)
(1)为了减轻汽车尾气造成的大气污染,人们开始探索利用NO和CO在一定条件下转化为两种无毒气体E和F的方法(已知该反应△H<0). 在2 L密闭容器中加入一定量NO和CO,当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
T/℃ n/mol | NO | CO | E | F |
初始 | 0.100 | 0.100 | 0 | 0 |
T1 | 0.020 | 0.020 | 0.080 | 0.040 |
T2 | 0.010 | 0.010 | 0.090 | 0.045 |
①请结合上表数据,写出NO与CO反应的化学方程式 .
②根据表中数据判断,温度T1和T2的关系是(填序号)__________。
A.T1>T2B.T1<T2 C.T1=T2 D.无法比较
(2)已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g); ΔH= - 1266.8 kJ/mol
N2(g) + O2(g) = 2NO(g) ; ΔH = + 180.5kJ/mol,
则氨催化氧化的热化学方程式为________________________________________。
(3)500℃下,在A、B两个容器中均发生合成氨的反应。隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
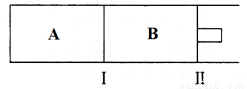
当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。则此条件下的平衡常数为___________;保持温度和压强不变,向此容器中通入0.36molN2,平衡将___________(填“正向”、“逆向”或“不”)移动。
(4)在相同的密闭容器中,用方法Ⅱ和方法Ⅲ制得的两种Cu2O分别进行催化分解水的实验:
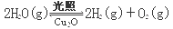 ΔH >0
ΔH >0
水蒸气的浓度(mol·L-1)随时间t (min)变化如下表:
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
可以判断:实验①的前20 min的平均反应速率 ν(O2)= ;催化剂的催化效率:实验① 实验②(填“>”、“<”)。
(5)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极和乙醛-Na2SO4溶液为电解质溶液,乙醛分别在阴、阳极转化为乙醇和乙酸。
总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。
CH3CH2OH+CH3COOH。
过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com