
在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g)  3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是______(用序号填空).
①4 mol A+2 mol B ②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D ④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
(4分) (1)吸热(1分) (2)③(1分) (3)0.5 2.5(2分)
【解析】
试题分析:(1)根据方程式可知,反应前后体积不变,但气体的质量减小。所以若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,这说明升高温度,平衡向正反应方向移动,即正方应是吸热反应。
(2)维持容器体积和温度不变,达到平衡时C的浓度仍为1.2mol/L,为等效平衡,且为完全等效平衡,按化学计量数转化到左边满足2molA和1molB即可,由2A(g)+B(g)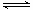 3C(g)+D(S)可知:
3C(g)+D(S)可知:
①4molA+2molB与初始A、B的物质的量不同,故①错误;
②3molC+lmolD+1molB换算成A、B,A、B物质的量分别为2mol、2mol,与初始A、B的物质的量不同,故②错误;
③3molC+2molD 换算成A、B,A、B物质的量分别为2mol、1mol,D为1mol,D是固体,对平衡无影响,故③正确;
④1.6mol A+0.8mol B+0.6molC换算成A、B,没有D,C不能反应,与初始A、B的物质的量不相同,故④错误,答案选③。
(3)若C未转化时,C的物质的量为3mol,此时体积最大,所以容器的体积V=3mol÷1.2mol/L=2.5L;若D完全反应时,平衡时C的物质的量最小,此时体积最小,根据方程式计算反应的C的物质的量:
2A(g)+B(g)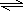 3C(g)+D(S)
3C(g)+D(S)
2.4mol 0.8mol
所以C的物质的量最小为3mol-2.4mol=0.6mol
所以容器的体积V=0.6mol÷1.2mol/L=0.5L
考点:考查可逆反应的有关判断和计算、等效平衡的应用
点评:该题是高考中的常见题型,属于中等难度试题的考查,侧重对学生分析、归纳和总结问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。采用极限反应法是解(3)题的关键,采用极限反应法求出C的物质的量,从而求出容器体积范围。


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com