
| A. | 能全部透过半透膜 | B. | 没有丁达尔现象 | ||
| C. | 所得液体透过滤纸 | D. | 所得物质一定是浊液 |
分析 由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,以此来解答.
解答 解:分散系中分散质的直径在1nm~100nm之间的属于胶体分散系,
由“纳米技术”是指粒子直径在几纳米到几十米的材料,则分散到液体分散剂中,分散质的直径在1nm~100nm之间,则该混合物属于胶体.
A.胶粒能透过滤纸,不能透过半透膜,故A错误;
B.胶体具有丁达尔现象,故B错误;
C.胶体可能呈胶状,故C正确;
D.该混合物属于胶体,不属于悬浊液或乳浊液,故D错误;
故选C.
点评 本题考查分散系的判断及胶体的性质,明确纳米材料的直径是解答本题的关键,题目难度不大.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 23g钠在氧气中完全燃烧失去电子数为0.5NA | |
| B. | 1L 2 mol•L-1的AlCl3溶液中含Al3+数为2NA | |
| C. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| D. | 室温下,8g甲烷含有共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰石与稀盐酸制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应生成白色沉淀:Ba2++SO42-═BaSO4↓ | |
| C. | 钠与水反应后的溶液显碱性:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 二氧化硅与氢氧化钠溶液反应生成硅酸钠:SiO2+2OH-═SiO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:
化学反应中的能量变化,通常主要表现为热量的变化.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.测定中和热的实验装置如图所示:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗相同质量的硫酸 | B. | 消耗相同质量的锌 | ||
| C. | 消耗相同质量的氧化铜 | D. | 生成的硫酸锌质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应均为氧化还原反应 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 同温同压下,相同体积的物质,其物质的量必然相等 | |
| D. | 摩尔是七个基本物理量之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时正极上有气泡产生 | B. | 电池放电时Cl-由负极向正极迁移 | ||
| C. | 正极反应式为Ag++e-=Ag | D. | 负极副反应为Mg+H2O=Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
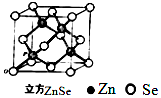 硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.
硒化锌是一种透明色半导体,也可作为红光外学材料,熔点1520℃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com